Структура, својства, номенклатура и употреба сребрног оксида (Аг2О)
Тхе силвер окиде је неорганско једињење чија је хемијска формула Аг2О. Сила која спаја његове атоме је потпуно јонске природе; дакле, он се састоји од јонске чврсте супстанце где постоји однос два Аг катиона+ интеракција електростатички са анионом О2-.
Оксидни анион, О2-, резултат је интеракције атома сребра површине са кисеоником околине; на сличан начин као и гвожђе и многи други метали. Сребрни комад или накит уместо црвенила и рушења, постаје црн, карактеристичан за сребрни оксид.

На пример, на слици изнад можете видети ружасту сребрну чашу. Забиљежите његову црну површину, иако она и даље задржава неки орнаментални сјај; зато се чак и зарђали предмети од сребра могу сматрати довољно привлачним за декоративне сврхе.
Својства сребрног оксида су таква да на први поглед не кваре изворну металну површину. Формира се на собној температури једноставним контактом са кисеоником у ваздуху; и још занимљивије, може се распасти на високим температурама (изнад 200 ° Ц).
То значи да би, ако би се држало стакло слике, а топлота интензивног пламена била примијењена, повратила свој сребрни сјај. Стога је његово формирање термодинамички реверзибилан процес.
Сребрни оксид има и друга својства, а изван своје једноставне Аг формуле2Или обухвата сложене структурне организације и богату разноликост чврстих тијела. Међутим, Аг2Или је можда, поред Аг2О3, најрепрезентативнији од оксида сребра.
Индек
- 1 Структура сребрног оксида
- 1.1 Промене са бројем валенције
- 2 Физичка и хемијска својства
- 2.1 Молекуларна тежина
- 2.2 Изглед
- 2.3 Густина
- 2.4 Тачка топљења
- 2.5 Кпс
- 2.6 Растворљивост
- 2.7 Ковалентни карактер
- 2.8 Декомпозиција
- 3 Номенклатура
- 3.1 Валенциас И и ИИИ
- 3.2. Систематска номенклатура за комплексне оксиде сребра
- 4 Усес
- 5 Референце
Структура сребрног оксида
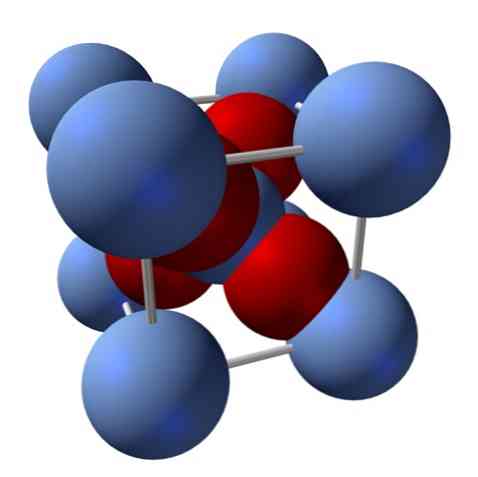
Каква је његова структура? Као што је речено на почетку: то је јонска чврста материја. Из тог разлога у својој структури не могу постојати ковалентне везе Аг - О нити Аг = О; пошто би, ако би постојала, својства овог оксида би се драстично променила. Тада су Аг иони+ и О2- у омјеру 2: 1 и доживљава електростатичку привлачност.
Структура сребрног оксида се одређује као посљедица начина на који ионске силе располажу у простору Аг иона+ и О2-.
На горњој слици, на пример, имате јединичну ћелију за кубични кристални систем: Аг катионе+ су сребрно плаве сфере и О2- црвенкасте сфере.
Ако бројите сфере, видећете да на први поглед има девет сребрно плавих и четири црвене боје. Међутим, узимају се у обзир само фрагменти сфера садржаних у коцки; рачунајући ове, као фракције укупних сфера, мора бити задовољен однос 2: 1 за Аг2О.
Понављање структурне јединице тетраедра АгО4 окружен са још четири Аг+, изграђена је сва црна крутина (отклањање празнина или неправилности које ови кристални аранжмани могу имати).
Мења се са бројем валенциа
Фокусирање сада није на АгО тетраедар4 али у линији АгОАг (посматрати вертикале горње коцке), чврсто сребро-оксид се састоји из више перспектива, више слојева јона распоређених линеарно (иако нагнутих). Све то као резултат "молекуларне" геометрије око Аг+.
Наведено је поткријепљено неколико студија његове ионске структуре.
Сребро ради претежно са валенцијом +1, јер при губљењу електрона његова електронска конфигурација је [Кр] 4д10, која је веома стабилна. Остале валенције, као што је Аг2+ анд Аг3+ оне су мање стабилне јер губе електроне из орбитала скоро у потпуности попуњене.
Агон3+, међутим, он је релативно мање нестабилан у поређењу са Аг2+. У ствари, он може коегзистирати у друштву Аг+ Хемијски обогаћују структуру.
Његова електронска конфигурација је [Кр] 4д8, са неспареним електронима на такав начин да јој даје неку стабилност.
За разлику од линеарних геометрија око Аг иона+, Утврђено је да је то Аг иона3+ То је квадратни стан. Дакле, сребрни оксид са Аг јонима3+ састојала би се од слојева састављених од АгО квадрата4 (не тетраедре) електростатички повезане АгОАг линијама; Такав је случај Аг4О4 Аг2О ∙ Аг2О3 са моноклинском структуром.
Физичке и хемијске особине

Ако огребете површину сребрне чаше главне слике, добићете чврсту, која није само црна, већ има смеђе или смеђе тонове (горња слика). Неке од његових физичких и хемијских особина које су описане у тренуцима су следеће:
Молекуларна тежина
231,735 г / мол
Изглед
Чврсто црно-браон у облику праха (имајте на уму да упркос томе што је ионска чврста материја, нема кристални изглед). Без мириса је и помијешан са водом даје метални укус
Густина
7.14 г / мЛ.
Тачка топљења
277-300 ° Ц. Наравно, топи се у чврсто сребро; то јест, вероватно се разбија пре формирања течног оксида.
Кпс
1.52. 10-8 у води на 20 ° Ц. Због тога је једињење једва растворљиво у води.
Растворљивост
Ако пажљиво погледате слику његове структуре видећете да су сфере Аг2+ и О2- Не разликују се готово по величини. Као резултат, само мали молекули могу да продру у унутрашњост кристалне решетке, чинећи га нерастворљивим у скоро свим растварачима; осим оних у којима реагује, као што су базе и киселине.
Ковалентни карактер
Иако је више пута речено да је сребров оксид јонско једињење, одређена својства, као што је ниска тачка топљења, супротна су овој тврдњи..
Свакако, разматрање ковалентног карактера не разбија оно што је објашњено за његову структуру, било би довољно да се дода у структуру Аг \ т2Или модел сфера и шипки који указују на ковалентне везе.
Такође, тетраедре и квадратне равни АгО4, као и АгОАг линије, оне би биле повезане ковалентним (или ковалентним ионским) везама.
Имајући то у виду, Аг2Или би заправо био полимер. Међутим, препоручује се да се то посматра као јонска чврста твар са ковалентним карактером (чија је природа везе и данас изазов).
Децомпоситион
У почетку је поменуто да је његово формирање термодинамички реверзибилно, тако да апсорбује топлоту да се врати у своје метално стање. Све ово се може изразити са две хемијске једначине за такве реакције:
4Аг (с) + О2(г) => 2Аг2О (с) + К
2Аг2О (с) + К => 4Аг (с) + О2(г)
Где К представља топлоту у једначини. Ово објашњава зашто ватра која гори на површини захрђале сребрне чаше враћа њен сребрни сјај.
Стога је тешко претпоставити да постоји Аг2О (л) јер би се одмах растворила топлотом; осим ако је притисак превисок за добијање те смеђе црне течности.
Номенклатура
Када је уведена могућност Аг иона2+ анд Аг3+ поред уобичајене и доминантне Аг+, појам 'сребрни оксид' почиње да изгледа недовољно да се односи на Аг2О.
То је зато што Аг+ више је од других, тако да се узима Аг2Или као једини оксид; што уопште није тачно.
Ако узмете у обзир Аг2+ као практично непостојећи с обзиром на његову нестабилност, тада ће бити присутни само иони са валенцијама +1 и +3; то јест, Аг (И) и Аг (ИИИ).
Валенциас И и ИИИ
Будући да је Аг (И) најмање валенца, названа је додавањем суфикса -осо његовом имену аргентум. Дакле, Аг2Или је то: аргентосо оксид или, према систематској номенклатури, диплома моноксид.
Ако је Аг (ИИИ) потпуно игнорисан, тада његова традиционална номенклатура мора бити: сребров оксид умјесто аргентинског оксида.
С друге стране, Аг (ИИИ) као веца валенција додаје се суфиксу -ицо у његово име. Дакле, Аг2О3 је: сребров оксид (2 Аг иони)3+ са три О2-). Такође, његово име према систематској номенклатури би било: диплома триоксид.
Ако се посматра структура Аг2О3, може се претпоставити да је то производ оксидације озоном, ОР3, уместо кисеоника. Због тога, његов ковалентни карактер мора бити већи јер је то ковалентно једињење са Аг-О-О-О-Аг или Аг-О везама.3-Аг.
Систематска номенклатура за комплексне оксиде сребра
АгО, такође написана као Аг4О4 Аг2О ∙ Аг2О3, то је сребрни оксид (И, ИИИ), јер има и валенције +1 и +3. Његово име према систематској номенклатури би било: тетраплате тетраоксид.
Ова номенклатура је од велике помоћи када су у питању други стехиометријски комплекснији оксиди сребра. На пример, претпоставимо две чврсте материје 2Аг2О ∙ Аг2О3 анд Аг2О ∙ 3Аг2О3.
Писање првог на прикладнији начин би било: Аг6О5 (бројање и додавање атома Аг и О). Његово име би онда било хексаплат пентоксид. Имајте на уму да овај оксид има сребрени састав мање богат од Аг2О (6: 5) < 2:1).
У супротном, пишући другу чврсту боју, то би био: Аг8О10. Његово име би било октаплат децаокиде (са односом 8:10 или 4: 5). Овај хипотетички оксид сребра би био "веома оксидисан".
Усес
Данас се још увијек проводе студије у потрази за новим и софистицираним упорабама за оксид сребра. Неке од његових употреба су наведене испод:
-Раствара се у амонијаку, амонијум нитрату и води да би се формирао Толленс реагенс. Овај реагенс је користан алат у квалитативним анализама у лабораторијама органске хемије. Омогућава одређивање присуства алдехида у узорку, позитиван одговор је формирање "сребрног огледала" у епрувети.
-Заједно са металним цинком формира примарне батерије цинковог оксида сребра. Ово је можда једна од најчешћих и најчешћих употреба.
-Он служи као пречишћивач гаса, апсорбујући на пример ЦО2. Када се загреје, ослобађа заробљене гасове и може се поново користити неколико пута.
-Због антимикробних својстава сребра, његов оксид је користан у истраживањима биоанализе и пречишћавања земљишта.
-То је благо оксидационо средство које може оксидовати алдехиде у карбоксилне киселине. Такође се користи у Хофманновој реакцији (терцијарни амини) и учествује у другим органским реакцијама, било као реагенс или катализатор.
Референце
- Бергстрессер М. (2018). Сребрни оксид: Формула, разградња и формација. Студија. Преузето са: студи.цом
- Аутори и уредници књига ИИИ / 17Е-17Ф-41Ц. (с.ф.). Сребрни оксиди (Аг (к) О (и)) кристална структура, параметри решетке. (Нумерички подаци и функционални односи у науци и технологији), вол. 41Ц. Спрингер, Берлин, Хеиделберг.
- Махендра Кумар Триведи, Рама Мохан Таллапрагада, Алице Брантон, Дахрин Триведи, Гопал Наиак, Омпракасх Латииал, Снехасис Јана. (2015). Потенцијални утицај третмана енергијом биопоља на физичке и термалне особине праха сребровог оксида. Интернатионал Јоурнал оф Биомедицал Сциенце анд Енгинееринг. Вол. 3, Но. 62-68. дои: 10.11648 / ј.ијбсе.20150305.11
- Сулливан Р. (2012). Разлагање оксида сребра. Университи оф Орегон Преузето са: цхемдемос.уорегон.еду
- Флинт, Деианда. (24. април 2014). Користи батерије од сребрног оксида. Сциенцинг. Добављено из: сциенцинг.цом
- Салман Монтасир Е. (2016). Испитивање неких оптичких својстава оксида сребра (Аг2о) помоћу УВВисибилног спектрофотометра. [ПДФ] Преузето са: иосрјоурналс.орг
- Бард Аллен Ј. (1985). Стандардни потенцијали у воденом раствору. Марцел Деккер. Преузето са: боокс.гоогле.цо.ве


