Хемијска структура, својства и употреба мангановог оксида (МнО2)
Тхе манганесе окиде (МнО2) је неорганско хемијско једињење које формира елемент манган са оксидационим бројем +4 и кисеоником, који у формирању оксида има оксидациони број -2. Познат је и по именима манганов (ИВ) оксид и манганов анхидрид.
Чврста је од тамне до црне кафе. У природи је као минерални пиролусит, црни и кристализовани формирајући дендрити (разгранато издужење). Може се добити као црни остатак у реакцији између етилена и калијум перманганата након формирања гликола оксидационим дејством калијум перманганата..

Веома је важан у индустрији стакла због свог карактера оксидационог агенса, јер уклања зелену боју која потиче од једињења гвожђа и претвара их у гвожђе.
Индек
- 1 Хемијска структура
- 2 Својства
- 3 Усес
- 3.1 Као катализатор
- 4 Ефекти на здравље
- 5 Референце
Хемијска структура
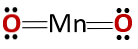
Хемијска структура једињења одговара анхидриду, а не базичном оксиду, као што би се очекивало јер се састоји од метала и неметала.
Овај посебан случај је последица понашања које манган има у различитим оксидационим стањима. Тако за оксидациона стања +2 и +3 формирају се оксиди МнО и Мн2О3 респективно, да при реакцији са водом формирају манганов хидроксид и манганов хидроксид, респективно.
Међутим, Мн2О3 у благо киселом средству понаша се као анхидрид. Са оксидационим стањем +4, +6 и +7, МнО2, МнО3 и МнО4 стварају киселине када реагују са водом.
У благо киселој средини МнО2 понаша се као основни оксид, тако да може да формира одговарајући хидроксид.

Мора се имати на уму да се у овом случају не спомињу амфотерна својства, према којима се једињење може понашати као киселина или као база. Ово је посебан случај понашања Мн.
Пропертиес
Усес
- Користи се као извор мангана
- Као оксидант у алкалним батеријама
- Боје за стакло, керамику и порцелан.
- У добијању хлора и јода.
- У разлагању водоник пероксида за формирање гасовитог кисеоника и воде.
- У реакцији разлагања калијум хлората за производњу гасовитог кисеоника и калијум хлорида.
- Раствара се у ацетону или у дихлорометану, оксидише примарне алкохоле у алдехиде и секундарне у кетоне.
- Производња алкалних батерија.
Као катализатор
Ово се односи на реакције редукције оксида, за уклањање сулфида као што је Х2С и катиони као Фе+2 и Мн+2 , арсен и радио који се налазе у подземним водама које су загађене овом врстом једињења.
Ова контаминација се може генерисати или неконтролисаним одлагањем отровних материја, прањем контаминираног земљишта или присуством хемијских елемената у време добијања воде..
Тхе МнО2 Висока чистоћа добијена из пиролузита који се користи као филтер (Филок) је најефикасније средство за уклањање ове класе нечистоћа из подземних вода.
Ефекти на здравље
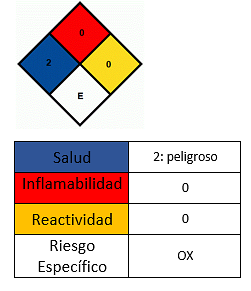
- Избегавајте контакт са кожом.
- У случају контакта, опрати одговарајуће подручје.
- Не удишите прах.
- Иритација и црвенило се могу видети у контакту са очима. Исперите са пуно воде, пустите да вода тече кроз очи и позовите медицинску помоћ у случају озбиљних проблема.
- У контакту са кожом примећена је иритација и црвенило. Оперите захваћено подручје с много воде и сапуна.
- Продужени контакт са кожом уклања вашу природну маст, изазивајући дерматитис.
- Удисање може проузроковати стање слично грипу (металне паре). Стање карактерише висока температура, зимица, сува уста и грло, бол у мишићима и главобоља.
- Може иритирати респираторни тракт и повећати учесталост респираторних инфекција (пнеумонија). Интоксикација апсорпцијом неорганских соли мангана кроз плућа је мало вероватна, али може доћи до хроничног тровања.
- Хронично излагање прашини или диму манган-диоксида током дужег периода може утицати на централни нервни систем и довести до развоја Паркинсонове болести, потешкоћа са ходањем, мишићних грчева и промена понашања.
- Гутање може изазвати бол у стомаку и мучнину.
- Није запаљив, али помаже у ширењу ватре у ужареним материјалима. Ако се загреје на температуру изнад 535 ° Ц, супстанца се разлаже на манганов оксид (ИИИ) Мн2О3 и кисеоник, који је запаљив и повећава опасност од пожара. У том случају пожар треба угасити пјеном или угљичним диоксидом.
- У случају излијевања, немојте манипулирати саставом без одговарајуће особне заштите.
- Чувати смешу у добро затвореним контејнерима, на хладном и сувом месту и даље од некомпатибилних супстанци као што су органски материјали и запаљиви материјали.
- Место складиштења мора бити суво и имати подове отпорне на киселинску корозију и са добром дренажом..
- Треба користити личну заштитну опрему, као што су рукавице, заштитне наочаре, маске против паре, прашина и дим.
Референце
- Б, (2015), Манган диоксид, Краљевско хемијско друштво - свет хемије, преузето из цхемистриворлд.цом
- Карал, (2014), Мангнесо Диокиде, Безбедносни лист, Извучен из, карал.цом.мк
- Ваш виртуални учитељ (2015-02-25). Манганова неорганска једињења (специјални случај 1) - Теоријска лекција, преузета из, иоутубе.цом
- Ецуред, (с.ф), манганов диоксид, из ецуред.цу
- Ангарита Г, Јохнни., (2017), Манганов диоксид: Изузетна технологија. Хидротец, рецоверед фром хидротецоцр.цом
- Фернандез, Г., (2015), МнО манган диоксид2/ ацетон, Органиц Цхемистри, Опорављено од куимицаорганица.нет
- Тронок, (2011), Манган диоксид, Безбедносни лист, Опорављен од, тронок.цом


