Формула литијум оксида, својства, ризици и употреба
Тхе литијум оксид је неорганско хемијско једињење формуле Ли2Или да се формира заједно са малим количинама литијум-пероксида када се литијум спаљује у ваздуху и комбинује са кисеоником..
До деведесетих година на тржишту метала и литија доминирала је америчка производња минералних сировина, али је почетком 21. века највећи део производње био изведен из не-америчких извора; Аустралија, Чиле и Португал су били најважнији добављачи у свету. Боливија има половину литијских депозита у свијету, али није велики произвођач.
Најважнији комерцијални облик је литијум карбонат, Ли2ЦО3, производи се од минерала или слане воде различитим процесима.
Када се литиј сагори у ваздуху, главни производ је бели оксид литијум оксида, Ли2О. Поред тога, добије се и неки литијум-пероксид, Ли2О2, такође бела.
То се такође може урадити топлотном разградњом литијум хидроксида, ЛиОХ или литијум пероксида, Ли2О2.
4Ли (с) + О2(г) → 2Ли2О (с)
2ЛиОХ (с) + топлота → Ли2О (с) + Х2О (г)
2Ли2О2(с) + хеат → 2Ли2О (с) + О2(г)
Физичке и хемијске особине
Литиј оксид је бела чврста маса позната као литија која нема арому и слани укус. Његов изглед је приказан на слици 2 (Национални центар за биотехнолошке информације, 2017).

Слика 2: изглед литијум оксида
Литиј оксид су кристали са геометријом антифлорита сличном оној натријум хлорида (кубични центриран на лицима). Његова кристална структура приказана је на слици 3 (Марк Винтер [Универзитет Схеффиелд и ВебЕлементс Лтд, 2016]).
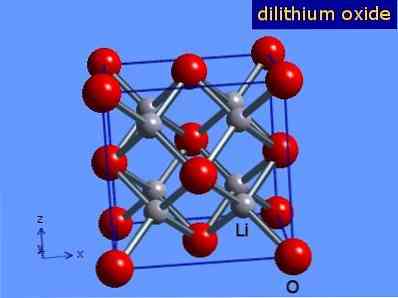
Слика 3: кристална структура литијум оксида.
Његова молекулска тежина је 29.88 г / мол, густина је 2.013 г / мЛ, а тачке топљења и кључања су 1438 ° Ц и 2066 ° Ц. Једињење је веома растворљиво у води, алкохолу, етру, пиридину и нитробензену (Краљевско хемијско друштво, 2015).
Литијум оксид лако реагује са воденом паром да би се формирао хидроксид, а са угљен диоксидом се формира карбонат; стога се мора складиштити и руковати у чистој и сувој атмосфери.
Оксидна једињења не доводе до струје. Међутим, одређени структурирани оксиди перовскита су електронски проводници који проналазе примену у катоди чврстих оксидних горивих ћелија и система за генерисање кисеоника..
То су једињења која садрже најмање један кисеонични анион и један метални катион (Америцан Елементс, С.Ф.).
Реактивност и опасности
Литиј оксид је стабилно једињење које није компатибилно са јаким киселинама, водом и угљен диоксидом. Према нашим сазнањима, хемијска, физичка и токсиколошка својства литијум оксида нису истражена и приказана у дубини.
Токсичност литијумских једињења је функција њихове растворљивости у води. Литијум јон има токсичност централног нервног система. Једињење је јако корозивно надражујуће ако дође у контакт са очима, кожом, када се удише или прогута (ЕСПИ МЕТАЛС, 1993).
У случају контакта са очима, проверите да ли носите контактна сочива и одмах их уклоните. Очи треба испирати текућом водом најмање 15 минута, држати капке отворене. Можете користити хладну воду. Маст не треба користити за очи.
Ако хемикалија дође у контакт са одећом, уклоните је што је брже могуће, штитећи своје руке и тело. Ставите жртву под сигурносни туш.
Ако се хемикалија накупља на изложеној кожи жртве, као што су руке, пажљиво и пажљиво оперите кожу контаминирану текућом водом и неабразивним сапуном. Можете користити хладну воду. Ако се иритација настави, потражити медицинску помоћ. Оперите контаминирану одећу пре поновне употребе.
У случају удисања, жртви треба омогућити одмор у добро проветреном простору. Ако је удисање отежано, жртву треба што прије евакуирати у сигурну зону.
Отпустите чврсту одјећу као што су овратник за кошуље, ремење или кравату. Ако је жртви тешко дисати, треба применити кисеоник. Ако жртва не дише, обавља се реанимација уста на уста.
Увек имајући у виду да може бити опасно за особу која пружа помоћ да се реанимира уста на уста када је инхалирани материјал отрован, заразан или корозиван.
У свим случајевима треба одмах потражити медицинску помоћ (СИГМА-АЛДРИЦХ, 2010).
Усес
Литиј оксид се користи као флукс у керамичким глазурама и ствара плаво са бакром и ружама са кобалтом. Литиј оксид реагује са водом и паром, формирајући литијум хидроксид и мора бити изолован од њих.
Литиј оксид (Ли2О) са високим потенцијалом за трицијум је атрактиван кандидат за чврсти материјал културе ДТ фузионе електране, због његове високе густине литијумских атома (у поређењу са другим литијумским или металик литијум керамиком) и њене проводљивости релативно висока топлота (ЛИТХИУМ ОКСИДЕ (Ли2О), СФ).
Ли2Или ће бити изложена високим температурама у току неутронског зрачења током рада фузионих ћебади. У овим околностима, велики број дефеката зрачења ће се појавити у Ли2Или, као што је бубрење индуковано хелијем, релативно висока топлотна експанзија, раст зрна, формирање ЛиОХ (Т) и таложење на ниским температурама и транспорт масе ЛиОХ (Т) на високим температурама.
Поред тога, Ли2Или ће бити изложена напрезањима која настају због разлика у топлинском ширењу између Ли2О и структурни материјали. Ове карактеристике Ли2Или доводе до изазовних инжењерских проблема у производњи и дизајну покривача.
Могућа нова употреба је замена за кобалт и литијум оксид као катоду у литијум-јонским батеријама које се користе за напајање електронских уређаја од мобилних телефона до лаптопа, као и аутомобила са батеријским напајањем (Реаде Интернатионал Цорп, 2016).
Референце
- Марк Винтер [Универзитет Схеффиелд и ВебЕлементс Лтд. (2016). вебелементс. Преузето из Литхиум: дилитхиум окиде вебелементс.цом.
- Америцан Елементс. (С.Ф.). Литиј оксид. Преузето из америцанелементс америцанелементс.цом.
- ЕСПИ МЕТАЛС. (1993, јун). Литиј оксид. Преузето из еспиметалс еспиметалс.цом.
- Литиј оксид (Ли2О). (С.Ф.). Преузето са ферп.уцсд.еду ферп.уцсд.еду.
- Национални центар за биотехнолошке информације. (2017, 24. јун). ПубЦхем Цомпоунд Датабасе; ЦИД = 166630. Преузето из ПубЦхем пубцхем.нцби.нлм.них.гов.
- Реаде Интернатионал Цорп.. Прах литиј оксида (Ли2О). Преузето из реаде реаде.цом
- Краљевско хемијско друштво. (2015). Литиј оксид.Преузето са цхемспидерцхемспидер.цом.
- СИГМА-АЛДРИЦХ. (2010). Лист са подацима о сигурности литијум оксида. Преузето са цхемблинк цхемблинк.цом.


