Тхеори оф Бандс Модел анд Екампле
Тхе банд тхеори је онај који дефинише електронску структуру целине као целине. Може се примијенити на било коју врсту крутине, али је у металима гдје се одражавају његови највећи успјеси. Према овој теорији, метална веза је резултат електростатског привлачења између позитивно наелектрисаних јона и мобилних електрона у кристалу..
Дакле, метални кристал има "море електрона", који може објаснити његове физичке особине. Доња слика приказује металну везу. Пурпурне тачке електрона делокализују се у мору које обавија позитивно набијене атоме метала.

"Море електрона" се формира од појединачних доприноса сваког атома метала. Ови доприноси су његове атомске орбитале. Металне конструкције су генерално компактне; што су компактније, то су веће интеракције између њихових атома.
Као резултат, њихове атомске орбитале се преклапају да би генерисале веома уске молекуларне орбитале у енергији. Море електрона је онда само велики скуп молекуларних орбитала са различитим опсезима енергија. Распон ових енергија чини оно што је познато као енергетске траке.
Ове траке су присутне у било ком региону кристала, због чега се сматра као целина, а одатле долази дефиниција те теорије..
Индек
- 1 Модел енергетских опсега
- 1.1 Ферми ниво
- 2 Семицондуцторс
- 2.1. Унутрашњи и спољашњи полупроводници
- 3 Примери примењене теорије бендова
- 4 Референце
Модел енергетских опсега

Када с орбиталом металног атома ступи у интеракцију са суседном (Н = 2), формирају се две молекуларне орбитале: једна веза (зелена трака) и једна од анти-линк (тамно црвена трака).
Ако је Н = 3, сада се формирају три молекуларне орбитале, од којих је средња (црна трака) невезујућа. Ако је Н = 4, формирају се четири орбитале и раздвајају оне са највећим везним карактером и оне са највећим анти-замрзавајућим карактером..
Распон расположиве енергије за молекуларне орбитале се шири како атоми метала кристала обезбеђују њихове орбитале. Ово такође доводи до смањења енергетског простора између орбитала, до тачке да се кондензују у појасу.
Овај појас састављен од орбитала има области ниске енергије (оне зелене и жуте боје) и високе енергије (оне наранџасте и црвене боје). Њихови енергетски екстреми имају ниску густину; међутим, већина молекуларних орбитала (бела пруга) је концентрисана у центру.
То значи да електрони "трче брже" кроз центар траке него на својим крајевима.
Ферми ниво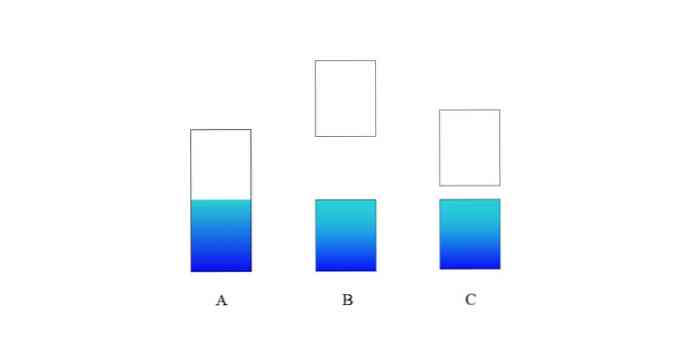
То је највеће енергетско стање које заузимају електрони у чврстом стању на апсолутној нултој температури (Т = 0 К).
Када се трака изгради, електрони почињу да заузимају све њихове молекуларне орбитале. Ако метал има један валентни електрон (е)1), сви електрони у њеном кристалу заузимају половину траке.
Друга ненастањена половина је позната као покретна трака, док се пуна електрона назива валентни појас.
На горњој слици А представља типичан валентни појас (плави) и проводни појас (бели) за метал. Плава линија границе означава ниво Фермија.
Пошто метали такође имају п-орбитале, они се комбинују на исти начин да потичу п-појас (бели).
У случају метала, с и п траке су веома блиске у енергији. То омогућава њихово преклапање, промовишући електроне из валенцијског појаса у проводни појас. То се дешава чак и на температурама мало изнад 0 К.
За прелазне метале и од периода 4 према доле, такође је могуће формирати траке од.
Ниво Фермија у односу на проводни појас је веома важан за одређивање електричних својстава.
На пример, метал З са Фермијевим нивоом веома близу проводног опсега (најближи празни појас у енергији) има већу електричну проводљивост од Кс метала у коме је његов Ферми ниво далеко од тог опсега..
Семицондуцторс
Електрична проводљивост се затим састоји од миграције електрона из валентног појаса у проводни појас.
Ако је енергетски јаз између обе траке веома велик, имамо изолациону чврсту масу (као код Б). С друге стране, ако је ова празнина релативно мала, чврста је полупроводник (у случају Ц).
Суочени са порастом температуре, електрони у валентној зони добијају довољно енергије да мигрирају према проводном појасу. То резултира електричном струјом.
У ствари, ово је квалитет чврстих или полупроводничких материјала: на собној температури су изолатори, али на високим температурама они су проводници.
Унутрашњи и спољашњи полупроводници

Унутрашњи проводници су они у којима је енергетски размак између валентног опсега и проводног опсега довољно мали да топлотна енергија дозвољава пролаз електрона.
С друге стране, спољашњи проводници показују промене у својим електронским структурама након допирања нечистоћама, које повећавају њихову електричну проводљивост. Ова нечистоћа може бити други метал или неметални елемент.
Ако нечистоћа има више валентних електрона, она може да обезбеди донорску траку која служи као мост за електроне валентне траке да пређу у проводни појас. Ове чврсте материје су полуводичи н-типа. Овде н ознака долази од "негативног".
У горњој слици донаторска трака је приказана у плавом блоку непосредно испод покретне траке (Тип н).
С друге стране, ако нечистоћа има мање валентних електрона, она обезбеђује акцепторску траку, која скраћује енергетски размак између валентног опсега и покретне траке..
Електрони прво мигрирају према овом појасу, остављајући иза себе "позитивне рупе", које се крећу у супротном смјеру.
Како ови позитивни размаци означавају пролаз електрона, чврсти материјал или материјал је полупроводник п-типа..
Примери примењене теорије бендова
- Објасните зашто су метали светли: њихови мобилни електрони могу апсорбовати зрачење у широком опсегу таласних дужина када пређу на виши ниво енергије. Затим емитују светлост, враћајући се на ниже нивое возне траке.
- Кристални силицијум је најважнији полуводички материјал. Ако је дио силикона допиран са траговима елемента групе 13 (Б, Ал, Га, Ин, Тл), он постаје полупроводник п-типа. Ако је допиран елементом групе 15 (Н, П, Ас, Сб, Би), он постаје полупроводник н-типа.
- Светлећа диода (ЛЕД) је заједнички полуводич п-н. Како то мислиш? Да материјал има оба типа полупроводника, и н и п. Електрони мигрирају из проводног опсега полупроводника н-типа, у валентни појас полупроводника п-типа.
Референце
- Вхиттен, Давис, Пецк & Станлеи. Цхемистри (8. изд.). ЦЕНГАГЕ Леарнинг, стр. 486-490.
- Схивер & Аткинс. (2008). Неорганска хемија (Четврто издање, стр. 103-107, 633-635). Мц Грав Хилл.
- Схип Ц. Р. (2016). Банд Теорија чврстих материја. Преузето 28. априла 2018. године, од: хиперпхисицс.пхи-астр.гсу.еду
- Стеве Корнић (2011). Идемо од обвезница до бендова са тачке гледишта хемичара. Преузето 28. априла 2018. године, са: цхембио.уогуелпх.ца
- Википедиа. (2018). Ектринсиц семицондуцтор. Преузето 28. априла 2018. године, са: ен.википедиа.орг
- БИЈУ'С. (2018). Банд теорија метала. Преузето 28. априла 2018. године, од: бијус.цом



