Формула натријум сулфата, својства, структура, апликације
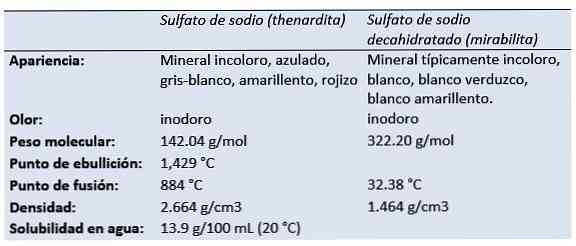
Тхе натријум сулфат (динатријумова со сумпорне киселине, динатријум тетраоксидосулфат, сода сулфата, сол Глаубера, онардита, мирабилита) је неорганско једињење са формулом На2СО4 и сродне хидрате. Сви облици су беле чврсте материје које су високо растворљиве у води.
Сматра се једним од главних хемијских производа који се продају. Његова светска производња (готово искључиво у облику декахидрата) износи око 6 милиона тона годишње.

Онардит је анхидровани минерал натријум сулфата који се производи у аридним околинама испаравања, у сувим пећинама, у старим рударским операцијама као цветање, и као депозит око фумарола.
Први пут је описан 1825. године у Салинас Еспартинас (Циемпозуелос, Мадрид, Шпанија) и назван је итардита у част француског хемичара Лоуиса Јацкуеса Тхенарда (1777-1826).

Холандски / немачки хемичар и апотекар Јоханн Рудолф Глаубер (1604-1670) открио је 1625. године, у води једног аустријског извора, натријум сулфат декахидрат (касније познат као Глауберова сол). Звао га је мирабилис сол (чудесна со), због својих љековитих својстава.
Између 1650. и 1660. Глаубер је почео да производи натријум сулфат из обичне соли (НаЦл) и концентроване сумпорне киселине. Овај процес се сматра почетком хемијске индустрије.
Њени кристали су коришћени као лаксатив до 20. века.
У осамнаестом веку, реакција Глауберове соли са поташом (калијум карбонат) почела је да се користи у индустријској производњи соде (натријум карбонат)..

Тренутно се углавном користи за производњу детерџената иу Крафт процесу за производњу папирне пулпе (доминантна метода у производњи папира).
Наслаге минерала натријум сулфата налазе се у Сједињеним Државама, Канади, Шпанији, Италији, Турској, Румунији, Мексику, Боцвани, Кини, Египту, Монголији и Јужној Африци..
Главни произвођачи су Кина (провинције Јиангсу и Сицхуан), а затим Шпанија, у којој се налази највећи глауберити у свијету (Церезо де Рио Тирон, Бургос).
Укупна свјетска производња природног натријум сулфата процјењује се на око 8 милиона тона, а као нуспроизвод других индустријских процеса између 2 и 4 Мт..
У Шпанији, према информацијама објављеним у Националном инвентару ресурса натријум сулфата и другим ажурираним подацима, процењене количине минерала натријум сулфата реда 730 Мт су каталогизоване као "резерве", а 300 Мт више је каталогизовано као "други ресурси".
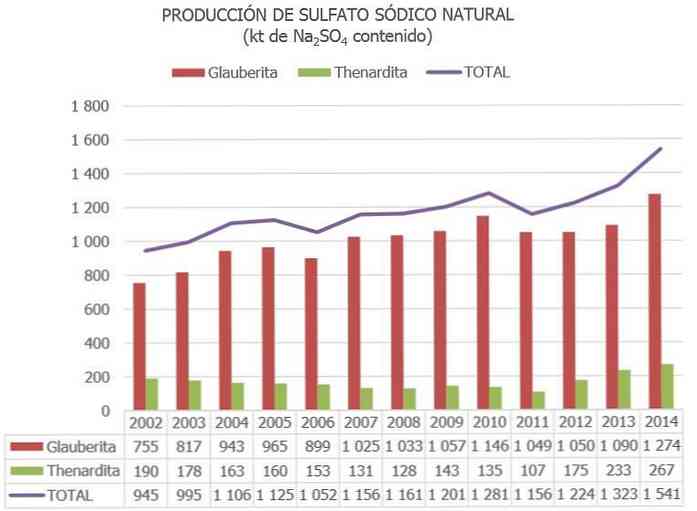
У Европској унији, Шпанија је тренутно једина земља са рудама натријум сулфата (углавном онеардита, глауберита и мирабилита).
Тренутно постоји опћи пад потражње за натријум сулфатом у текстилном сектору.
Последњих година, други сектори, као што су детерџенти, доживјели су одређени раст, у неким регионима, због њихове ниске цене као сировине.
Главна тржишта која шире детерџенте за натријум сулфат налазе се у Азији, Средњој Америци и Јужној Америци.
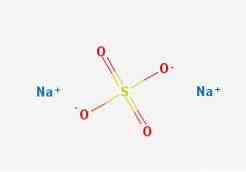
Формуле

2Д струцтуре
3Д струцтуре
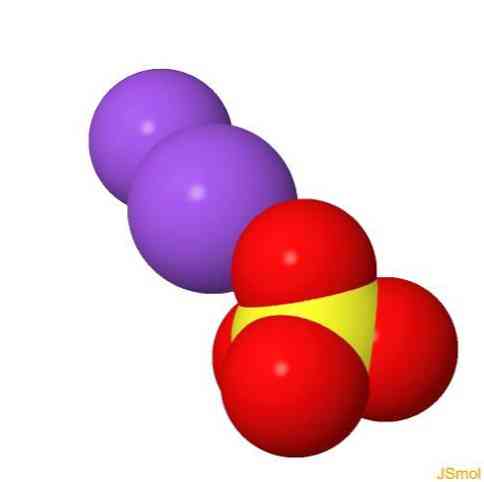
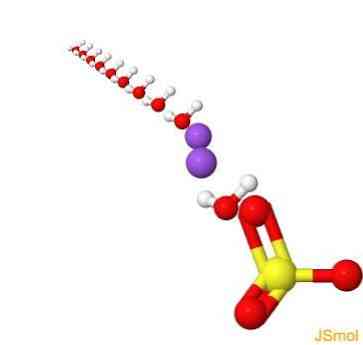
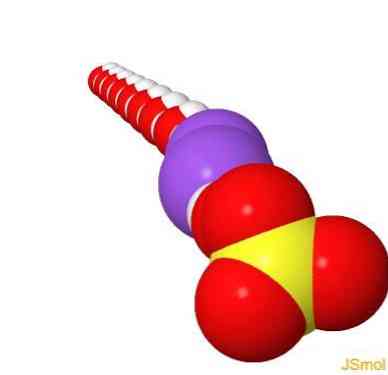
Феатурес
Физичке и хемијске особине
Натријум сулфат припада реактивној групи натријумских једињења и припада групи сулфата, хидрогенсулфата и дисулфита..
Запаљивост
То је незапаљива супстанца. Нема опасности од експлозије праха.
Реактивност
Натријум сулфат је веома растворљив у води и хигроскопан. Веома је стабилан, не реактиван према већини оксидирајућих или редукционих средстава при нормалним температурама. На високим температурама може се конвертовати у натријум сулфид карботермалним редукцијом.
Хемијски нереактивне супстанце сматрају се нереактивним у типичним условима околине (иако могу реаговати у релативно екстремним околностима или у катализи). Отпорне су на оксидацију и редукцију (осим у екстремним условима).
Опасне хемијске реакције
Када се алуминијум растали заједно са натријум или калијум сулфатом, долази до јаке експлозије.
Токсичност
Хемијски нереактивне супстанце сматрају се нетоксичним (иако гасовити материјали из ове групе могу да делују као гушиоци).
Иако се натријум сулфат генерално сматра не-токсичним, са њим се мора поступати пажљиво. Прах може изазвати астму или привремену иритацију ока. Овај ризик се може избјећи ношењем заштите за очи и папирне маске.
Усес
Његове главне примене су у производњи:
- детерџент у праху.
- папирна пулпа.
- текстил.
- стакла.
- синтеза ензима (производња вина).
- људску и животињску храну.
- апотека.
- основна хемија уопште.
- процеси челика.
- Детергент повдер
Натријум сулфат је веома јефтин материјал. Његова највећа употреба је као пунило у кућним прашкастим детерџентима, трошећи цца. 50% светске производње. Нови компактни или течни детерџенти не укључују натријум сулфат, тако да се ова употреба смањује.
Још једна употреба натријум сулфата која се смањује, посебно у САД. и Канада, је у Крафт процесу за производњу дрвне пулпе. Напредак у топлинској ефикасности процеса драстично је смањио потребу за натријум сулфатом.
Индустрија стакла представља још једну важну апликацију за натријум сулфат. То је друга највећа примјена у Европи. Натријум сулфат се користи за елиминисање малих ваздушних мехурића из растопљеног стакла.
У Јапану, највећа примена натријум сулфата је у производњи текстила. Натријум сулфат помаже да боје продре равномерно у влакна и не кородира посуде од нерђајућег челика које се користе у бојању (за разлику од натријум хлорида, који је алтернативна метода).
Натријум сулфат је посебно погодан за складиштење нискоквалитетне соларне топлоте (за касније ослобађање у апликацијама за грејање) због високог капацитета складиштења топлоте током промене фазе из чврстог у течну, која се даје на 32 ° Ц.
За примену у хлађењу, смеша са обичном соли натријум хлорида (НаЦл) смањује тачку топљења на 18 ° Ц.
У лабораторији се анхидровани натријум сулфат нашироко користи као инертно средство за сушење, да би се уклонили трагови воде из органских раствора. Његова активност је спорија од магнезијум сулфата, али се може користити са различитим материјалима, јер је хемијски сасвим инертна.
Натријум сулфат декахидрат (Глауберова со) се у прошлости користио као лаксатив. Ефикасан је за елиминацију одређених лекова као што је ацетаминофен (ацетаминофен) из организма након предозирања.
Остале примене за натријум сулфат укључују, његову употребу као адитива у производњи освеживача тепиха, као додатак храни за стоку и за производњу скроба.
Клинички ефекти
За терапеутске примене, натријум сулфат спада у категорију сланих и катарзичних лаксатива који се користе у лечењу констипације..
Солне катарзе су соли које задржавају течности у цревима осмотским деловањем не апсорбоване соли, производећи индиректно повећање перисталтике.
Слане катарзе слабо се апсорбују у гастроинтестиналном тракту, тако да је системска токсичност мало вероватна уколико се не унесу велике количине. Међутим, велика излагања могу изазвати дехидратацију и промене електролита услед осмотских ефеката једињења.
Хронично злоупотреба лаксатива може се јавити код пацијената са поремећајима у исхрани, Мунцхаусен синдромом или фактичним поремећајима. Уопштено, пацијенти имају мучнину, повраћање и дијареју повезану са грчевима у трбуху. Тешки ефекти могу укључивати дехидрацију, хипотензију, хипернатремију и поремећаје електролита.
Сигурност и ризици
Изјаве о опасностима глобално хармонизованог система за класификацију и означавање хемикалија (ДГУ).
Глобално хармонизовани систем за класификацију и означавање хемикалија (ДГУ) је међународно усаглашен систем, који су направили Уједињени народи, а који је заменио различите стандарде класификације и означавања који се користе у различитим земљама, користећи конзистентне глобалне критеријуме (Уједињене нације) Унитед, 2015).
Класе опасности (и одговарајуће поглавље ГХС-а), стандарди класификације и означавања и препоруке за натријум-сулфат су (Европска агенција за хемикалије, 2017, Уједињене нације, 2015, ПубЦхем, 2017):
Класе опасности од ГХС
Х315: Изазива иритацију коже [Упозорење Нагризање / иритација коже - Категорија 2].
Х317: Може изазвати алергијску реакцију коже [Сензибилизација упозорења, Кожа - Категорија 1].
Х319: Изазива озбиљну иритацију ока [Упозорење Озбиљно оштећење ока / иритација ока - Категорија 2А].
Х412: Штетно за водене организме са дуготрајним штетним дејствима [Опасно по водену животну средину, дуготрајна опасност - Категорија 3].
(ПубЦхем, 2017)
Кодови пруденцијалних савјета
П261, П264, П272, П273, П280, П302 + П352, П305 + П351 + П338, П321, П332 + П313, П333 + П313, П337 + П313, П362, П363 и П501.
Референце
- ЦхемИДплус (2017) 3Д структура 7757-82-6 - Натријум сулфат анхидрован [имаге]. Преузето са: цхем.нлм.них.гов.
- ЦхемИДплус (2017) 3Д структура 7727-73-3 - Содиум сулфате [УСП] [имаге]. Преузето са: цхем.нлм.них.гов.
- Диет, Д. (2007) Тхенардите Натријум сулфат близу Содавилле Минерал Цоунти Невада [имаге] Добављено из: ен.википедиа.орг.
- Европска агенција за хемикалије (ЕЦХА), (2017). Сажетак класификације и означавања. Хармонизована класификација - Анекс ВИ Уредбе (ЕЗ) бр. 1272/2008 (Уредба ЦЛП). Натријум сулфат.
- Груметисхо (2012) Мирабилита [имаге] Добављено из: ес.википедиа.орг.
- Банка података о опасним супстанцама (ХСДБ). ТОКСНЕТ (2017). Натријум сулфат Бетхесда, МД, ЕУ: Национална медицинска библиотека. Преузето са: токнет.нлм.них.гов.
- Геолошки и рударски институт Шпаније (ИГМЕ) (2016). ГЛАУБЕРИТА-ТХЕНАРДИТА (НАТУРАЛ СОДИУМ СУЛПХАТЕ) 2014. Панорама рударства. Добављено из: игме.ес.
- Национални институт за безбедност на раду (ИНСХТ). (2010). Интернатионал Сафети Цхемицал Рецордс. Натријум сулфат. Министарство за запошљавање и безбедност. Мадрид ЕС Добављено из: инсхт.ес.
- Лангбеин Рисе (2008) Цонтинуоус крафт пулп мил (имаге) Ретриевед фром: викимедиа.орг.
- Уједињене нације (2015). Глобално хармонизовани систем за класификацију и означавање хемијских производа (ДГУ) Шесто ревидирано издање. Њујорк, Сједињене Државе: публикација Уједињених нација. Преузето са: унеце.орг.
- Национални центар за биотехнолошке информације. ПубЦхем Цомпоунд Датабасе (2016) натријум сулфат - ПубЦхем Струцтуре [имаге] Бетхесда, МД, ЕУ: Натионал Либрари оф Медицине. Преузето са: пубцхем.нцби.нлм.них.гов.
- Национални центар за биотехнолошке информације. ПубЦхем Цомпоунд Датабасе (2016) натријум сулфат - ПубЦхем Струцтуре [имаге] Бетхесда, МД, ЕУ: Натионал Либрари оф Медицине.
- Национални центар за биотехнолошке информације. ПубЦхем Цомпоунд Датабасе. (2017). Натријум сулфат безводни. Бетхесда, МД, ЕУ: Национална медицинска библиотека. Преузето са: пубцхем.нцби.нлм.них.гов.
- Национални центар за биотехнолошке информације. ПубЦхем Цомпоунд Датабасе. (2017). Натријум сулфат Бетхесда, МД, ЕУ: Национална медицинска библиотека. Преузето са: пубцхем.нцби.нлм.них.гов.
- Валкерма (2005) Содиум сулфате Добављено из: викимедиа.орг.
- Википедиа (2017) Крафт процес. Преузето са: википедиа.орг.
- Википедиа (2017) Мирабилита. Преузето са: википедиа.орг.
- Википедиа (2017) Мирабилите. Преузето са: википедиа.орг.
- Википедиа (2017) Содиум сулфате. Преузето са: википедиа.орг.
- Википедиа (2017) Солфато ди содиум децаидрате. Преузето са: хттпс://ит.википедиа.орг.
- Википедиа (2017) Содиум сулфате. Преузето са: википедиа.орг.
- Википедиа (2017). Преузето са: википедиа.орг.
- Википедиа (2017) Преузето са: .википедиа.орг.


