Органске соли физичке и хемијске особине, употребе и примери
Тхе органске соли они су густ број јонских једињења са небројеним карактеристикама. Они претходно произлазе из органског једињења, које је прошло кроз трансформацију која јој омогућава да буде носилац набоја, а то такође, њен хемијски идентитет зависи од придруженог јона..
На слици испод приказане су две веома опште хемијске формуле за органске соли. Први, Р-АКС, тумачи се као једињење у чијој угљеничној структури атом, или група А, носи позитивни набој + или негативан (-).
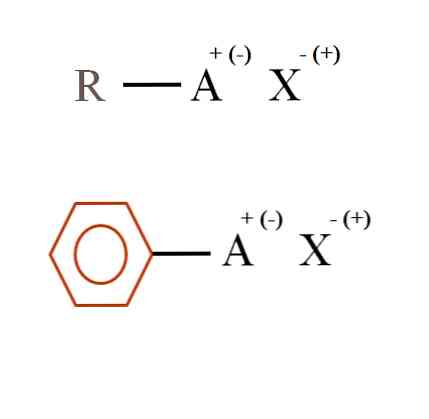
Као што се може видети, постоји ковалентна веза између Р и А, Р-А, али заузврат, А има формални набој који привлачи (или одбија) Кс иона.Знак набоја ће зависити од природе А и хемијског окружења..
Ако је А позитивна, са колико Кс може да ступи у интеракцију? Са само једним, с обзиром на принцип електронеутралности (+ 1-1 = 0). Међутим, који је идентитет Кс? Анион Кс може бити ЦО32-, који захтевају два катиона РА+; халогенид: Ф-, Цл-, Бр-, итд.; или чак, још један РА спој-. Опције су непроцјењиве.
Такође, органска со може имати ароматски карактер, илустровано у смеђем бензенском прстену. Сол бензоата бакра (ИИ), (Ц6Х5ЦОО)2Цу, на пример, састоји се од два ароматична прстена са негативно набијеним карбоксилним групама, који интерагују са Цу катионом.2+.
Индек
- 1 Физичка и хемијска својства
- 1.1 Високе молекуларне масе
- 1.2 Амфифили и сурфактанти
- 1.3 Висока температура кључања или тачке топљења
- 1.4 Киселост и базичност
- 2 Усес
- 3 Примери органских соли
- 3.1 Карбоксилати
- 3.2 Литијум диакрилупрати
- 3.3 Соли сулфонијума
- 3.4 Соли оксонијума
- 3.5 Соли амина
- 3.6 Диазонијумове соли
- 4 Референце
Физичке и хемијске особине
Из слике се може рећи да се органске соли састоје од три компоненте: органски, Р или Ар (ароматски прстен), атом или група која носи јонски набој А, и контраион Кс.
Као што су хемијски идентитет и структура дефинисани таквим компонентама, тако и њихове особине зависе од њих.
Из ове чињенице може се сумирати неке опште карактеристике које задовољавају велику већину ових соли.
Високе молекуларне масе
Под претпоставком моно или поливалентних анорганских Кс аниона, органске соли обично имају много веће молекулске масе од неорганских соли. Ово је углавном због угљеничног скелета, чије једноставне Ц-Ц везе, и њихови атоми водоника, доприносе много масе једињењу.
Према томе, они су Р или Ар одговорни за своје високе молекуларне тежине.
Амфифили и сурфактанти
Органске соли су амфифилна једињења, тј. Њихове структуре имају и хидрофилне и хидрофобне крајеве.
Какве су то крајности? Р или Ар представљају хидрофобни крај, јер њихови Ц и Х атоми немају велики афинитет за молекуле воде.
А+(-), атом или група која носи наелектрисање је хидрофилни крај, пошто доприноси диполарном моменту и интерагује са диполима који формирају воду (РА)+ ОХ2).
Када су хидрофилни и хидрофобни региони поларизовани, амфифилна со постаје сурфактант, супстанца која се широко користи за производњу детерџената и демулзификатори.
Високе тачке кључања или топљења
Као и неорганске соли, органске соли такође имају високе тачке топљења и кључања, због електростатских сила које владају у течној или чврстој фази.
Међутим, имајући органску компоненту Р или Ар, други типови Ван дер Ваалсових сила (Лондонске силе, дипол-дипол, водонични мостови) који се на одређени начин такмиче са електростатичким.
Из тог разлога, чврсте или течне структуре органских соли су, у првом реду, сложеније и разноврсније. Неки од њих се чак могу и понашати течни кристали.
Киселост и базичност
Органске соли су обично јаче киселине или базе него неорганске соли. То је зато што А, на пример у аминским солима, има позитиван набој због своје везе са додатним водоником: А+-Х. Затим, у контакту са базом, донирајте протон да се врати као неутрално једињење:
РА+Х + Б => РА + ХБ
Х припада А, али је написано како интервенише у реакцији неутрализације.
С друге стране, РА+ може бити велики молекул, неспособан да формира чврсте материје са кристалном мрежом која је довољно стабилна са хидроксил анионом или хидроксил ОХ-.
Када је то случај, сол РА+ОХ- понаша се као јака база; чак и основни као НаОХ или КОХ:
РА+ОХ- + ХЦл => РАЦл + Х2О
У хемијској једначини приметите да је Цл анион- замењује ОХ-, формирање соли РА+Цл-.
Усес
Употреба органских соли ће варирати у складу са идентитетом Р, Ар, А и Кс. Осим тога, примена на коју су намењена зависи и од врсте чврстог или течног облика. Неке опште у овом погледу су:
-Они служе као реагенси за синтезу других органских једињења. РАКС може да делује као "донор" Р ланца који се додаје другом једињењу које замењује добру излазну групу.
-Они су сурфактанти, тако да се могу користити и као мазива. Металне соли карбоксилата се користе за ову сврху.
-Омогућавају синтезу широког спектра боја.
Примери органских соли
Карбоксилати
Карбоксилне киселине реагују са хидроксидом у реакцији неутрализације, што доводи до настанка соли карбоксилата: РЦОО- М+; где М+ Може бити било који метални катион (На+, Пб2+, К+, итд.) или НХ амонијум катион4+.
Масне киселине су алифатске карбоксилне киселине дугог ланца, могу бити засићене и незасићене. Палмитинска киселина (ЦХ) је међу засићеним3(ЦХ2)14ЦООХ). То потиче од палмитатне соли, док стеаринска киселина (ЦХ3(ЦХ2)16ЦООХ формира стеаратну со. Сапуни су сачињени од ових соли.
У случају бензојеве киселине, Ц6Х5ЦООХ (где је Ц6Х5- то је бензенски прстен), када реагује са базом, формира бензоатне соли. У свим карбоксилатима, -ЦОО група- представља А (РАКС).
Литијумски дијакупупрати
Литијум диакупрат је користан у органској синтези. Његова формула је [Р-Цу-Р]-Ли+, где атом бакра носи негативан набој. Овде, бакар представља атом А слике.
Сулфонијумове соли
Они настају реакцијом органског сулфида са алкил халидом:
Р2С + Р'КС => Р2Р'С+Кс
За ове соли, атом сумпора носи позитиван формални набој (С+) са три ковалентне везе.
Оксонијумове соли
Такође, етри (оксидовани аналози сулфида) реагују са хидрокидима да би се формирале оксонијумове соли:
РОР '+ ХБр <=> РО+ХР '+ Бр-
Киселински протон ХБр је ковалентно везан за атом кисеоника етра (Р2О+-Х), пуњење позитивно.
Соли амина
Амини могу бити примарни, секундарни, терцијарни или кватерни, као и њихове соли. Сви они су карактерисани тиме што имају Х атом везан за атом азота.
Дакле, РНХ3+Кс- то је примарна сол амина; Р2НХ2+Кс-, секундарног амина; Р3НХ+Кс-, терцијарног амина; и Р4Н+Кс-, кватернарног амина (кватернарна амонијумова со).
Диазонијум соли
Коначно, соли диазонијума (РН2+Кс-) или арилдиазониум (АрН)2+Кс-), представљају полазну тачку за многа органска једињења, посебно за азо боје.
Референце
- Францис А. Цареи. Органиц Цхемистри (Сиктх едитион., Стр. 604-605, 697-698, 924). Мц Грав Хилл.
- Грахам Соломонс Т.В., Цраиг Б. Фрихле. Органиц Цхемистри. Аминес (10. издање.). Вилеи Плус.
- Википедиа. (2018). Сол (Хемија). Такен фром: ен.википедиа.орг
- Стевен А. Хардингер. (2017). Илустрован речник органске хемије: соли. Преузето са: цхем.уцла.еду
- Цхеврон Ороните. (2011). Карбоксилати. [ПДФ] Преузето са: ороните.цом


