Формула калцијум хидроксида, својства, реактивност и употреба
Тхе калцијум хидроксид, такође познат као хидратисани креч или гашено креч, је неорганско једињење формуле Ца (ОХ)2.
Калцијум хидроксид усваја полимерну структуру, као и сви метални хидроксиди, идентичан оном магнезијум хидроксида (Мг (ОХ))2) такође познат као бруцита.
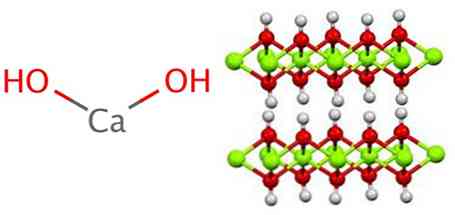
Може се видјети да у овој структури постоји формирање водикових мостова. Калцијум хидроксид се синтетизује индустријски реаговањем калцијум оксида, такође познатог као креч или вапно, са водом према следећој реакцији:
ЦаОХ + Х2О → Ца (ОХ)2
Такође се припрема у лабораторији реакцијом између воденог раствора калцијум хлорида и натријум хидроксида.
Калцијум хидроксид се јавља природно, али ретко у свом минералном облику као портландит, који се налази у неким вулканским и метаморфним стенама. (Формула калцијум хидроксида - употреба, својства, структура и формула калцијум хидроксида, 2005-2017).
Ово једињење је такође уобичајено у цементима, растварачима и индустријским средствима за чишћење (као што су грађевински производи), средства за скидање подова, средства за чишћење цигле, производи за згушњавање цемента и многи други..
Водени раствор се обично назива лимеватер. Вапна вода се припрема мешањем калцијум хидроксида у чистој води и филтрирањем сувишка Ца (ОХ).2 не распуштен.
Када се вишак калцијум хидроксида дода у кречну воду, добија се суспензија честица калцијум хидроксида, која му даје млечни изглед, у ком случају има уобичајено име кречног млека. Млеко вапна или засићени раствор вапна (вапнена вода) има пХ од 12,3, што је основне природе.
Физичке и хемијске особине калцијум хидроксида
Калцијум хидроксид је бели или безбојни прах, без мириса. У воденом раствору (засићеним растворима) има млечни изглед због супернатанта нераствореног калцијум хидроксида.
Незасићени раствори су обично бистри и безбојни раствори, са благим земљаним мирисом и горким алкалним укусом калцијум хидроксида. Изглед једињења је илустрован на слици 3 (Роиал Социети оф Цхемистри, 2015).

Калцијум хидроксид има молекулску масу од 74.093 г / мол и густину од 2.211 г / цм3 у чврстом стању. Има тачку топљења од 580 степени Целзијуса. Слабо је растворљив у води, те је у стању да раствори 1,89 грама по литру на 0 ° Ц, 1,73 грама по литру при 20 ° Ц и 0,66 грама по литру на 100 ° Ц.
Растворљив је у глицеролу и киселим растворима. Није растворљив у алкохолу (Национални центар за биотехнолошке информације, С.Ф.).
Калцијум хидроксид је делимично растворен у води да би се добило раствор који се зове вапнена вода, што је умјерена база. Вапна вода или Ца (ОХ)2 (ак) Он реагује са киселинама да формира соли и може напасти неке метале као што је алуминијум. Вапна вода лако реагује са угљен-диоксидом да би формирала калцијум-карбонат, што је користан процес који се назива карбонација:
Ца (ОХ)2 + ЦО2 → ЦаЦО3 + Х2О
Нитропарафини, нитрометан, нитропропан, итд., Формирају соли са неорганским базама као што је калцијум хидроксид. Ове сухе соли су експлозивне. Једињење је хемијски слично натријум хидроксиду (НаОХ) или натријум оксиду (На2О). Оне неутралишу киселине егзотермно да би се формирале соли и вода.
Мешање ових материјала са водом може да произведе несигурне количине топлоте, јер се база раствара или разблажује. Базе реагују са одређеним металима (као што су алуминијум и цинк) да формирају металне оксиде или хидроксиде и стварају водонични гас.
Базе могу иницирати реакције полимеризације у полимеризирајућим органским једињењима, нарочито епоксидима. Запаљиви и / или токсични гасови могу бити генерисани амонијумовим солима, нитридима, халогенираним органима, различитим металима, пероксидима и хидропероксидима. Овај тип једињења често служи као катализатор (Цхемицал Датасхеет ЦАЛЦИУМ ХИДРОКСИДЕ, С.Ф.).
Реактивност и опасности

Калцијум хидроксид је стабилно једињење иако је некомпатибилно са јаким киселинама. Класификован је као иритантно једињење и међу опасностима које можемо издвојити:
Корозивно дјелује на очи (узрокује оштећење рожњаче или сљепило) и кожу (производи упалу и пликове).
Удисање прашине ће изазвати иритацију у гастроинтестиналном или респираторном тракту, које карактерише печење, кихање и кашљање. Тешка прекомјерна изложеност може узроковати оштећење плућа, асфиксију, несвјестицу или смрт. Упала ока карактерише црвенило, иритација и свраб (Лист са подацима о безбедности материјала Калцијум хидроксид, 2013).
Поновљено излагање очима на ниском нивоу прашине може изазвати иритацију и локално уништавање коже или дерматитис на кожи. Поновљено удисање прашине може произвести промјенљив степен иритације дишних путева или оштећења плућа.
Ако ова хемикалија дође у контакт са очима, треба је одмах опрати великом количином воде, повремено подижући доње и горње капке. Мора се добити хитна медицинска помоћ. Контактна сочива се не смију користити приликом рада с овом кемикалијом.
Ако ова хемикалија дође у контакт са кожом, кожу контаминирану сапуном и водом треба одмах испрати. Ако ова хемикалија продре у одећу, одмах уклоните одећу и исперите кожу водом. Ако иритација траје и након прања, потражите медицинску помоћ.
Ако се удахне велика количина ове хемикалије, изложену особу треба одмах преместити на свеж ваздух. Ако се дисање заустави, извршите реанимацију уста-на-уста, тако да жртва остане топла и на миру. Одмах потражите медицинску помоћ.
Ако се прогута, одмах потражити медицинску помоћ и, ако је могуће, показати контејнер или етикету (тровање калцијум хидроксидом, 2017.) \ Т.
Руковање и складиштење
- Једињење треба чувати у сувом контејнеру.
- Не гутајте или удишите прашину.
- У овај производ никада не треба додавати воду.
- У случају недостатка вентилације, донесите одговарајућу опрему за дисање.
- Избегавајте контакт са кожом и очима.
- Држите даље од некомпатибилних киселина.
- Чувајте посуду чврсто затворену.
- Чувати посуду на хладном и добро проветреном месту. Не складиштити изнад 25 степени Целзијуса.
Користи и апликације

Калцијум хидроксид се производи у великом обиму, лако се рукује и генерално је јефтин, тако да постоје многе примене и примене.
Значајна примена калцијум хидроксида је као флокулант у третману воде и отпадних вода. Формира пахуљасту напуњену крутину која помаже у уклањању мањих честица из воде, што резултира лакшим производом.
Ова примена је омогућена због ниске цене и ниске токсичности калцијум хидроксида. Такође се користи у третману свеже воде за подизање пХ воде. Сврха је да цијеви не нагризају када је базна вода кисела.
Друга велика примена је у папирној индустрији, где се користи у производњи натријум хидроксида. Ова конверзија је компонента познатог крафт процеса који се користи у екстракцији пулпе.
У системима за одржавање живота, као што су угљендиоксидни скрубер, нарочито у затвореним круговима ронилачких респиратора, где се литијум хидроксид, који је више каустичан, сматра преопасно.
Користи се као састојак у избељивању и малтерисању, са такозваним кречним малтером. У изградњи путева, калцијум хидроксид служи за побољшање квалитета земљишта.
Према Националним институтима за здравље, калцијум хидроксид се обично користи у стоматолошком раду као антимикробно средство и представља супстанцу избора да се формира заштитни слој познат као апикална баријера..
Апикалне баријере се обично користе као средство за избегавање некрозе пулпе у ситуацијама где би ендодонтска хирургија била посебно тешка, што је обично резултат незрелог трајног зуба..
Будући да калцијум хидроксид може помоћи у дезинфекцији зуба гдје инфекција већ постоји, може се користити као краткотрајни третман за смањење бола и упала у припреми за ендодонтску кирургију (Готтфриед Сцхмалз, 2009).
Служи као адитив за морску воду јер смањује атмосферски ЦО2 и ублажава ефекат стаклене баште.
У производњи метала, вапно се убризгава у струју отпадног гаса да би се неутралисале киселине, као што су флуориди и хлориди, пре него што се испусти у атмосферу.
Калцијум хидроксид се користи као активни алкални састојак у неким производима за релаксацију косе.
Према Цорнелл Центру за истраживање материјала, калцијум хидроксид може исправити коврчаву косу јер разбија дисулфидне везе које повезују цистеине, аминокиселине које су присутне у већим концентрацијама у природно коврчавој коси. Разбијање ових веза и њихово заптивање калцијум хидроксидом трајно мења физичку структуру третиране косе.
У бордојској мешавини, калцијум хидроксид служи да неутралише раствор и формира дуготрајни фунгицид.
Користи се у индустрији прераде нафте за производњу адитива за уље (салицилати, сулфиди, феноли), у петрохемијској индустрији за производњу чврстог уља разних брендова, као иу хемијској индустрији за производњу калцијум стеарата . Обично се користи за испитивање апсорпције угљен-диоксида и гаса.
Калцијум хидроксид се користи у производњи кочионих плочица, у припреми сувих смеша за фарбање и декорацију, као иу производњи смеша за пестициде.
Користи се и као додатак калцијуму и пХ / карбонатни пуфер за аквакултуру кораља у акваријумима гребена.
То је "алтернативни" природни инсектицид, већина пузавих инсеката, који умиру у контакту са њим, укључујући крпеље, буве, кукце и ларве (Руссивер, 2015)..
Калцијум хидроксид је ефикасно решење за одвајање длаке од коже животиња, у припреми за производњу коже.
Мешавина калцијум хидроксида и топле воде ствара купку у којој свеже кожу треба потопити до четири дана и често трести. Овај процес ослобађа косу и кожу, до те мере да се обично може уклонити руком.
Због ниске токсичности и мекоће својих основних својстава, гашени креч се у прехрамбеној индустрији широко користи за:
- Да разјасни сирови сок шећерне трске или шећерне репе у индустрији шећера, процесну воду за алкохолна пића и безалкохолна пића, киселе краставце и друге намирнице.
- Направите тортиље од кукуруза (помозите кукурузној брашни да се споје). Кукуруз кухан са кречом претвара се у никтамал, што значајно повећава биорасположивост ниацина, такође се сматра и укуснијим и лакшим за варење..
- Очистите раствор калцијума и магнезијум карбоната у производњи соли за прехрамбену и фармацеутску употребу.
- Ојачати воћне напитке, као што је сок од поморанџе, и формула за дојенчад (БАУМ, 2013).
Референце
- БАУМ, Ј. (2013, 16. август). Употреба калцијум хидроксида. Преузето са ливестронг.цом: ливестронг.цом.
- Формула калцијум хидроксида - Калцијум хидроксид Употреба, својства, структура и формула. (2005-2017). Добављено из софтсцхоолс.цом.
- Тровање калцијум хидроксидом. (2017, 7. фебруар). Добављено из медлинеплус.гов.
- Цхемицал Датасхеет ЦАЛЦИУМ ХИДРОКСИДЕ. (С.Ф.). Добављено из цамеоцхемицалс.ноаа.гов.
- Готтфриед Сцхмалз, Д.А. (2009). Биокомпатибилност денталних материјала. Берлин: спрингер.
- Лист са подацима о безбедности материјала Калцијум хидроксид. (2013, мај 21). Добављено из сциенцелаб: сциенцелаб.цом.
- Национални центар за биотехнолошке информације. (С.Ф.). ПубЦхем Цомпоунд Датабасе; ЦИД = 6093208. Преузето са пубцхем.нцби.нлм.них.гов.
- Краљевско хемијско друштво. (2015). Калцијум хидроксид. Преузето из ЦхемСпидер: цхемспидер.цом.
- Руссивер, М. (2015., 17. август). За шта се користи калцијум хидроксид? Добављено из куора: куора.цом.


