Киниоун основа за бојење и технике
Тхе Киниоун стаининг То је техника бојења која се користи за бојење бактерија и киселих паразита. Настао је из модификације боје Зиехл-Неелсен; Обе технике се тумаче на исти начин, али се разликују у два елемента: у припреми главног реагенса иу томе да Киниоун техника не користи топлоту.
Због тога је познат и као хладно модификовано Зиехл-Неелсен или Киниоун хладно бојење. Наведено је за бојење Мицобацтериум туберцулосис, Мицобацтериум лепрае, атипичне микобактерије, Ноцардиас сп, Цриптоспоридиум парвум, Цриптоспоридиум мелеагридис, Цриптоспоридиум фелис, Цриптоспоридиум мурис и Цицлоспорас цаиетаненсис.
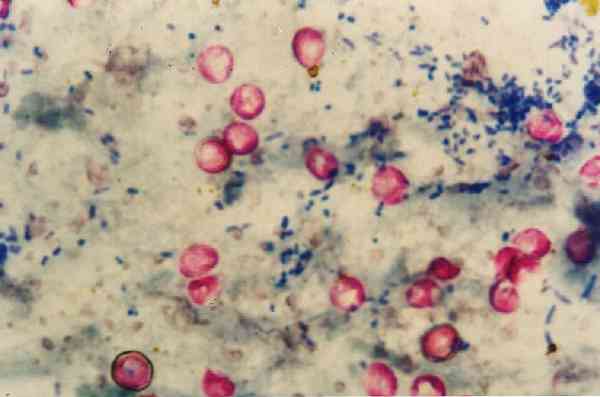
Важно је напоменути да Ноцардиас слабо осликава ову технику јер су дјеломично алкохолом отпорни на киселине, тако да за овај жанр постоји модификација методологије..
С друге стране, Киниоун хладна техника је комбинована са техником трихрома коју је модификовао Дидиер за откривање кокцидија (Цриптоспоридиум парвум е Исоспора беллии споре микроспоридије (Ентероцитозоон биенеуси и Енцепхалитозоон интестиналис).
Индек
- 1 Фоундатион
- 2 Техника
- 2.1 Материјали
- 2.2 Припрема киниоун феницатед фуцхсин
- 2.3 Припрема алкохолне киселине
- 2.4 Припрема контрастне боје за метиленско плаво
- 2.5 Техника киниоун боје
- 2.6 Специјална техника Киниоун за Ноцардиас
- 2.7 Комбинована техника фенолног и трихромног фуксина модификована од стране Дидијера
- 2.8 Контрола квалитета
- 3 Киниоун техника у поређењу са Зиехл техником -Неелсен
- 4 Референце
Фоундатион
Главни реагенс за бојење је карбол фуксин или фуксин феницада, који има својство везивања за карболне киселине које постоје унутар воскасте ћелијске стијенке, богате липидима (миколичким киселинама) микобактерија и одређених паразита..
Тај спој није сузбијен обезбојењем киселине; према томе, микроорганизми су дефинисани као алкохол отпоран на киселине.
За разлику од технике Зиехл-Неелсен - која фиксира боју кроз топлоту - у Киниоун техници овај корак није неопходан, јер фенолни раствор фуксина припремљен за ову технику садржи високу концентрацију фенола..
Фенол раствара липидни материјал ћелијског зида, што омогућава улазак царбол фуцхсин боје. Након што боја продре, остаје фиксирана упркос прању алкохолном киселином.
На овај начин, микроорганизми отпорни на киселину попримају карактеристичну црвену боју, док све што није алкохолно отпоран алкохол постаје обојен и обојен плавом бојом..
Техника
Материјали
- Модификовани фенолни фуксин.
- Алкохолна киселина.
- Метхилене блуе.
Припрема киниоун феницатед фуцхсин
- Основни фуксин: 4 гр.
- Фенол: 8 мл.
- Алкохол (95%): 20 мл.
- Дестилирана вода: 100 мл.
Основни фуксин у алкохолу мора се полако растопити, стално мијешати. Затим се кристализовани фенол тали у воденом купатилу на 56 ° Ц. Након растварања, додати 8 мл горе наведеном раствору фуксина.
Припрема алкохолне киселине
- Концентрована хлороводонична киселина: 3 мл.
- Етанол (95%): 97 мл.
Мора се мјерити, спајати и мијешати.
Припрема метилен плаве контрастне боје
- Метиленско плаво: 0.3 г.
- Дестилирана вода: 100 мл.
Измерена је и растворена.
Киниоун техника мрља
1- Припремите размаз директно из узорка, који може бити спутум, плућна течност, седимент урина, цереброспинална течност или фецес, између осталог; или из суспензије микроорганизама добијених из чистих колонија развијених у примарним медијумима културе.
2- Поправите размаз топлином.
3. Ставите мрљу на мост за бојење и покријте припремљеним Киниоун фенолним фуцхсин реагенсом. Нека седне 3 или 5 минута.
4. Исперите дестилованом водом.
5 Белећи са киселим алкохолом 3 минута и поново испрати дестилованом водом.
6 Блешите поново киселим алкохолом 1 или 2 минута док се више не увлачи боја.
7. Исперите дестилованом водом и пустите да се сливник стави у усправан положај.
8. Покријте препарат метиленским плавим и оставите 4 минуте.
9- Оперите дестилованом водом и осушите ваздух.
10. Испитајте на 40Кс, а затим на 100Кс.
Ако желите да побољшате и убрзате бојење микроорганизама са брзим киселинама, додајте 1 кап агенса за влажење (као што је тергитол бр. 7) у 30 или 40 мл Киниоун-овог фенолног фуксина..
Неке лабораторије мењају боју метиленског плавог контраста за светло зелену или пикринску киселину; прва даје зелену боју позадини, а друга жуту боју.
Техника Киниоун специјална за Ноцардиас
Да би се побољшало бојење бактерија Ноцардиа, коришћена је модификација Киниоун бојења. Техника је следећа:
1. Покријте мрљу киниоун феницатед фуцхсин 3 минуте.
2 Исперите дестилованом водом.
3 - Кратко избјељивати са 3% припремљеним киселим алкохолом док се више не унесе боја.
4- Опрати поново дестилованом водом.
5. Прекријте препарат метиленским плавим и оставите 30 секунди.
6. Исперите дестилованом водом и осушите ваздух.
Комбинована техника фенолног и трихромног фуксина модификована од стране Дидијера
Ова техника се препоручује за анализу узорака столице у потрази за кокцидијама и спорама Мицроспоридиум сп у исто време Процедура коју треба пратити је следећа:
1 - Покријте мрљу Киниоун фенолним фуксином 10 минута.
2. Уклоните боју и исперите дестилованом водом.
3- Бељење 30 секунди са алкохолном хлороводоничном киселином.
4- Опрати поново дестилованом водом.
5. Покријте размаз трихромским раствором 30 минута на 37 ° Ц.
6. Исперите дестилованом водом.
7. Деколоризујте 10 секунди алкохолом сирћетном киселином.
8 - Исперите размаз за 30 секунди користећи 95% етанол.
Контрола квалитета
Као позитивна контрола припремају се мрље са сојевима Мицобацтериум туберцулосис и обојене припремљеним реагенсима да би се потврдило да бактерије узимају праву боју (црвено-фуксија).
Негативне контроле могу се користити и припремом размаза било којим сојем који није алкохол који је отпоран на киселину, чиме се потврђује да цијели узорак узима боју контраста.
Киниоун техника у поређењу са Зиехл техником -Неелсен
Киниоун техника је једноставнија зато што елиминише степен грејања, али његова главна предност је што спречава емисију испарења, високо токсична и дугорочно изазива рак. Стога, Киниоун бојење је сигурније за бојење особља.
Важно је узети у обзир да је неопходно водити рачуна да реагенси не дођу у директан контакт са кожом, јер су корозивни и бјелило је запаљиво..
Што се тиче недостатака, негативни размаз не указује нужно да микроорганизам није присутан. Поред тога, присуство детритуса може изазвати лажне позитивне резултате, што доводи до забуне у дијагнози.
Референце
- Апплиед Цлиницал Цхемистри (2016). БК Киниоун Кит Доступно на: цромакит.ес
- Орозцо-Рицо Мигуел. Киниоун мрља и два Цоццидиа у ХИВ-у. Медицал Јоурнал МД. 2011; 3 (2): 137
- Форбес Б, Сахм Д, Веиссфелд А (2009). Микробиолошка дијагностика Баилеи & Сцотт. 12 ед. Аргентина Панамерицана С.А Уводник.
- Конеман Е, Аллен С, Јанда В, Сцхрецкенбергер П, Винн В. (2004). Микробиолошка дијагноза. (5. изд.). Аргентина, Уводник Панамерицана С.А..
- Википедиа цонтрибуторс. "Киниоун мрља." Википедиа, Тхе Фрее Енцицлопедиа. Википедиа, Тхе Фрее Енцицлопедиа, 8. фебруар 2018. Веб. 5. јануар 2019.
- Цомбол А, Фернандез Н, Фигуередо Е, Ацуна А, Занетта Е. Имплементација технике бојења за истовремену дијагнозу Цоццидиа и Мицроспоридиа. Институт за хигијену Универзитета Републике. Монтевидео. Уругвај Доступно на: хигиене.еду.уи


