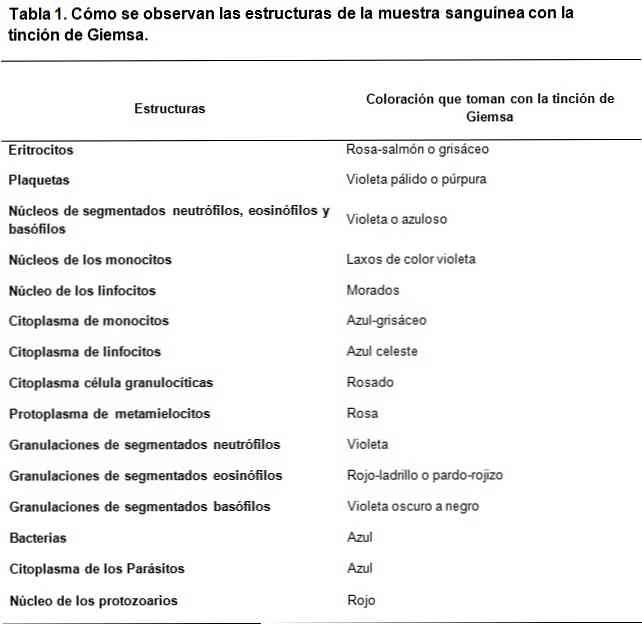
Гиемса темељ за бојење, материјале, технику и употребу
Тхе Гиемса мрља је врста бојења клиничких узорака, заснована на мешавини киселих и базних боја. Његово стварање је инспирисано радом Романовског, где га је Густав Гиемса, хемичар и бактериолог пореклом из Немачке, усавршио додавањем глицерола за стабилизацију једињења..
Промене генерисане оригиналном техником Романовског омогућиле су знатно побољшање микроскопских опажања, па је техника крштена именом Гиемса.
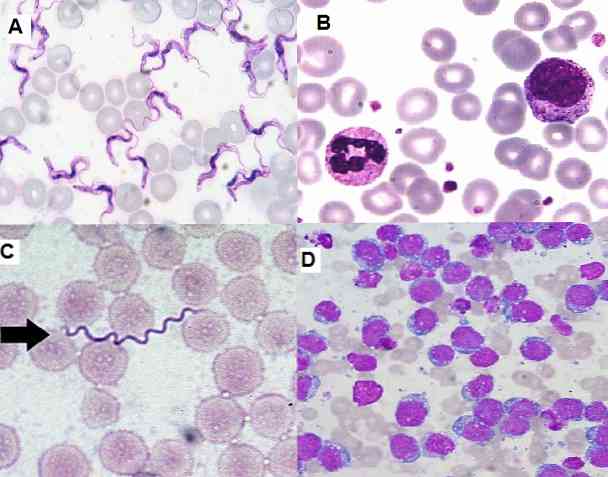
Пошто се ради о једноставној техници која је веома функционална и економична, она се тренутно широко користи у клиничкој лабораторији за хематолошке размазе, узорке коштане сржи и секције ткива..
Гиемса техника бојења је веома корисна за цитолошке студије, јер омогућава посматрање специфичних структура ћелија. Ова техника боји цитоплазме, језгре, језгре, вакуоле и грануле ћелија, те је у стању да разликује чак и фине трагове кроматина.
Поред тога, могу се детектовати значајне промене у величини, облику или обојености језгра, где је могуће визуелизовати губитак односа нуклеус-цитоплазма..
С друге стране, омогућава идентификацију незрелих ћелија у коштаној сржи и периферној крви, што је важно за дијагнозу озбиљних болести као што је леукемија. Такође је могуће детектовати хемопаразите, екстра и интрацелуларне бактерије, гљивице, између осталог.
У цитогенетици се доста користи, јер је могуће проучавати митозу ћелија.
Индек
- 1 Основа Гиемсине боје
- 2 Материјали
- 2.1 Материјали за припрему мајчиног раствора
- 2.2 Начин припреме мајчиног раствора
- 2.3 Материјали за припрему пуферског раствора
- 2.4 Завршна припрема боје
- 2.5 Додатни материјали потребни за обављање обојења
- 3 Техника
- 3.1 Процес бојења
- 4 Утилитиес
- 4.1 Хематологија
- 4.2 Микологија
- 4.3 Бактериологија
- 4.4 Паразитологија
- 4.5 Цитологија
- 4.6 Цитогенетика
- 5 Истраживање које показује ефикасност Гиемса бојења
- 6 Препоруке за добро бојење
- 7 Уобичајене грешке у бојању Гиемса
- 7.1 Изузетно плава боја
- 7.2 Превише ружичаста боја
- 7.3 Присуство талога у размазу
- 7.4 Присуство морфолошких артефаката
- 8 Режим складиштења
- 9 Референце
Основа Гиемсине боје
Боје типа Романовски се заснивају на употреби контраста између киселина и основних боја, да би се постигло бојење основних и киселих структура, респективно. Као што се може видети, постоји афинитет киселих боја за бојење основних структура и обрнуто.
Основна боја која се користи је метиленско плаво и његови оксидисани деривати (Азуре А и Азуре Б), док је киселинска боја еозин.
Киселе структуре ћелија су нуклеинске киселине, грануле сегментираних базофила, између осталог, стога ће бити обојене метиленским плавим..
У овом истом смислу, основне структуре ћелија су хемоглобин и неке грануле, као што су оне садржане у сегментираним еозинофилима, између осталих; оне ће бити обојене еозином.
С друге стране, због чињенице да се метиленско плаво и азурно одликују метахроматским бојама, оне могу да дају варијабилни тон различитим структурама у складу са оптерећењем полианиона које поседују..
Овако стратешка комбинација основних и киселих боја може да развије широк спектар боја, у складу са биохемијским карактеристикама сваке структуре, ходајући кроз бледо плаве, тамно плаве, јорговане и љубичасте тонове у случају киселих структура.
Док је обојеност коју пружа еозин стабилнија, стварају се боје између црвенкасто-наранџасте и лососове боје.
Материјали
Материјали за припрему мајчиног раствора
Припрема основног раствора захтева вагање 600 мг праха Гиемса боје, мерење 500 цц метилног алкохола без ацетона и 50 цм3 неутралног глицерина.
Начин припреме мајчиног раствора
Ставите тешки Гиемса прах у малтер. Ако постоје грудвице, треба их попрскати. Затим додајте значајну количину измереног глицерина и добро промешајте. Добијена смеша се сипа у веома чисту бочицу од амбера.
Остатак глицерина се ставља у малтер. Поново измешајте да очистите преосталу боју која је залепљена за зидове малтера и сипајте у исту боцу.
Боца је покривена и ношена 2 сата у воденом купатилу на 55 ° Ц. Док сте у купки с воденом купком, лагано промијешајте смјесу сваких пола сата.
Након тога, смеша се остави да се охлади да би се ставио алкохол. Претходно је један део измереног алкохола стављен у малтер да се заврши прање онога што је остало од боје и затим се додаје у смешу заједно са остатком алкохола..
Овај препарат треба оставити да сазрева најмање 2 недеље. Део који се користи од мајчиног раствора мора се филтрирати.
Да би се избегла контаминација препарата, препоручује се проћи део који ће бити у сталној употреби у малој ћилибарској бочици са капаљком. Напуните сваки пут када се реагенс понестане.
Материјали за припрему раствора пуфера
С друге стране, пуферни раствор на пХ 7.2 је припремљен на следећи начин:
Измерена је 6,77 грама натријум фосфата (анхидрованог) (НаХПО4), 2,59 г калијум дихидроген фосфата (КХ)2ПО4) и дестиловану воду до 1000 цм3.
Завршна припрема боје
За припрему коначног раствора за бојење, мерен је 2 цц филтрираног растворног раствора и помешан са 6 цм3 раствора пуфера. Мешавина је мешана.
Релевантна чињеница која се мора узети у обзир је да се технике припреме боје могу променити према комерцијалној кући.
Додатни материјали потребни за бојење
Осим описаних материјала, потребно је обезбиједити мостове у боји, водене заслоне или одбојнике за прање, листове за предмете или поклопце, штоперицу за контролу времена бојања и упијајући папир или неки материјал који се може користити за сушење ( газа или памук).
Техника
Процес бојења
1) Пре бојења, узорак се мора проширити на чисту плочицу..
Узорци могу бити крв, коштана срж, резови хистолошких ткива или цервико-вагинални узорци. Препоручује се да спољашњи слојеви буду танки и да имају 1 или 2 сата сушења пре него што их обоје.
2) Сви листови које морате обојити постављају се на обојени мост. Увек радите истим редоследом и добро идентификујте сваки лист.
3) Ставити неколико капи 100% метилног алкохола (метанола) на размаз и оставити 3 до 5 минута, да се фиксира и дехидрира узорак.
4) Баците метанол који се налази у листу и оставите да се осуши на ваздуху.
5) Када се осуши, ставите коначни раствор за бојење са капаљком док се не покрије читава плоча. Оставите га на 15 минута. Неки аутори препоручују до 25 мин. Зависи од комерцијалне куће.
6) Оциједите боју и исперите размаз дестилованом водом или са 7.2 пуферованим раствором.
7) На упијајућем папиру оставите да се листови осуше на отвореном, постављени вертикално уз помоћ носача.
8) Обришите задњу страну клизача газом или ватом натопљеном алкохолом да бисте уклонили преосталу боју.
Утилитиес
Гиемса техника бојења се користи у неколико области, укључујући: хематологију, микологију, бактериологију, паразитологију, цитологију и цитогенетику..
Хематологија
То је најчешћа корист која се даје овом боју. Уз то, можемо идентификовати сваку и сваку од ћелија присутних у узорцима коштане сржи или периферне крви. Као и процена броја сваке серије, могућност детекције леукоцитозе или леукопеније, тромбоцитопеније итд..
Пошто је осетљив на идентификацију незрелих ћелија, релевантан је у дијагностици акутних или хроничних леукемија. Такође је могуће дијагностицирати анемију, као што је болест српастих ћелија, болест српастих ћелија, између осталих..
Мицологи
У овој области уобичајено је да се користи за тражење Хистопласма цапсулатум (интрацелуларна диморфна гљивица) у узорцима ткива.
Бацтериологи
У хематолошким размазима обојеним Гиемсом могуће је детектовати Боррелиас сп код пацијената који имају болест која се назива рецуррентис грознице. Спирохете обилују еритроцитима, у узорцима узетим на фебрилном врху.
Такође је могуће визуелизовати интрацелуларне бактерије као Рицкеттсиас сп и Цхламидиа трацхоматис у инфицираним ћелијама.
Паразитологија
У области паразитологије, Гиемса бојење је омогућило дијагнозу паразитских болести као што су маларија, Цхагасова болест и леисхманијаза..
У прва два паразита Пласмодиум сп анд тхе Трипаносома црузи односно могу се визуализирати у периферној крви заражених пацијената, могу се наћи у различитим фазама у складу са фазом у којој је болест.
Да би се побољшала потрага за крвним паразитима, препоручује се употреба Гиемса боје која је помијешана са бојом Маи-Грунвалд.
Исто тако, кожни лишманијаза се може дијагностиковати када се процењују узорци биопсије коже обојене Гиемсом, где се проналази паразит..
Цитологи
Гиемса бојење се користи и за цитолошку студију ендоцервикалних узорака, иако није најчешће коришћена техника за ову сврху..
Али у случајевима оскудице ресурса може се користити, има функционалност сличну оној коју нуди Папаницолаоу техника и по нижој цијени. Међутим, то захтијева стручност испитивача.
Цитогенетика
Релевантна карактеристика Гиемса бојења је њена способност да се снажно веже на регионе богате ДНК аденинима и тиминима. Ово омогућава да се ДНК визуализује током митозе ћелија, у различитим стањима кондензације.
Ове студије су неопходне за детекцију хроматских аберација као што су дупликације, делеције или транслокације различитих региона хромозома..
Истраживања показују ефикасност Гиемса бојења
Цаннова и сарадници (2016) упоредили су 3 технике бојења за дијагнозу кожног лишманијазе.
За то су користили узорке добијене од експерименталне животиње (Месоцрисетус ауратус) експериментално инокулисан Леисхманиас.
Аутори су показали да је бојање Гиемса било боље од Пап-март® и Гаффнеи бојења. Према томе, сматрали су да је Гиемса боја идеална за дијагнозу кожног лишманијазе.
Одлични резултати добијени од стране аутора су последица чињенице да комбинација боја које чине Гиемса мешавину представљају неопходне услове за стварање повољног контраста, омогућавајући јасно разликовање амастиготних структура, и интра и екстрацелуларно..
Друге технике (Пап-март® и Гаффнеи) су то учиниле, али на слабији начин и стога теже визуализирати. Због тога се Гиемса боја препоручује за паразитолошку дијагностику леисхманијазе.
Исто тако, студија коју је спровео Рамирез и сарадници (1994), проценила је валидност Гиемса и Лендрум мрља у коњуктивалним размазима за идентификацију Цхламидиа трацхоматис.
Аутори су утврдили да Гиемса и Ледрум бојање имају исту специфичност, али Гиемса је била осјетљивија.
Ово објашњава зашто се тренутно Гиемса бојење најчешће користи за дијагностику хламидијских инфекција, посебно ако постоји мало ресурса.
Препоруке за добро бојење
Сушење плоча не би требало да се убрзава. Прудентно време се мора чекати да се осуши на отвореном. Приближно 2 сата.
Боје одмах након 2 сата за најбоље резултате.
За боље фиксирање и бојење размаза узорак мора бити расподељен на лист тако да остане танак и равномеран слој..
Пожељни узорак крви је капилара, јер се размаз врши директно из капи крви и зато узорак нема адитива, што погодује одржавању ћелијских структура..
Међутим, ако се користи венска крв, ЕДТА треба да се користи као антикоагулант, а не хепарин, пошто се последњи обично деформише ћелије..
Уобичајене грешке у бојању Гиемса
У пракси ове обојености, могу се направити грешке. О њима свједоче нагле промјене у нијансама структура.
Изузетно плава боја
Може бити:
- Веома густе мрље
- Прекорачење времена бојења
- Премало прање.
- Употреба реагенса знатно изнад неутралног пХ (алкална).
Под овим условима, боје следећих структура су изобличене, тако да ће еритроцити уместо умирући ружичасти лосос изгледати зелено, грануле еозинофила које треба обојити црвеном опеком ће постати плаве или сиве и тако даље. одступања у уобичајеним тоналитетима.
Прекомерно ружичаста боја
Може бити због:
- Недовољно време бојења.
- Продужено или претјерано прање.
- Бад дриинг.
- Употреба врло киселих реагенса.
У овом конкретном случају, структуре које су нормално обојене плаве боје неће бити скоро видљиве, док ће структуре које су замрљане ружичасте имати веома претеране тонове.
Примјер: еритроцити ће попримити јарко црвену или јаку наранчасту боју, нуклеарни хроматин ће изгледати блиједо ружичасто, а грануле еозинофила постају јарко црвене..
Присуство талога у размазу
Узроци могу бити:
- Користите прљаве или слабо испране листове.
- Не допустите да се размаз добро суши.
- Оставите решење за фиксирање предуго.
- Неадекватно прање на крају бојења.
- Неадекватна филтрација или не-филтрација боје која се користи.
Присуство морфолошких артефаката
Морфолошки артефакти могу се појавити у размазима, што отежава визуализацију и интерпретацију присутних структура. Ово је због:
- Тип антикоагуланта који се користи, као што је хепарин.
- Употреба прљавих, оштећених или масних листова.
Режим складиштења
Након припреме, боја треба да се чува на собној температури (15 - 25 ° Ц), како би се спречило таложење боје. Мора се чувати у затвореној амбалажи од јантара.
Референце
- Цаннова Д, Брито Е и Симонс М. Процјена техника бојања за дијагнозу кожног лишманијазе. Салус. 2016; 20 (2): 24-29.
- ПанРеац Апплицхем ИТВ Реагенси. Гиемса мрља. Верзија 2: ЈМБЈУЛ17 ЦЕИВД10ЕС. Цастеллар дел Валлес, Шпанија.
- Цларк Г. Стаининг процедуре (1981), 4тххед. Виллиамс & Виллкинс.
- Апплиед Цлиницал Цхемистри Гиемса боја за дијагнозу ин витро. Дистрибутер: цромакит.ес
- Рамирез И, Мејиа М, Гарциа де ла Рива Ј, Хермес Ф и Гразиосо Ц. Валидност Гиемса и Лендрум мрља у коњуктивалним размазима за идентификацију Цхламидиа трацхоматис. Бол оф Санит Панам. 1994; 116 (3): 212-216.
- Цасас-Ринцон Г. Генерална микологија. 1994. 2. Ед Универсидад Централ де Венезуела, издања библиотеке. Венецуела, Царацас.
- "Гемса мрља." Википедиа, Тхе фрее енцицлопедиа. 1 сеп 2017, 01:02 УТЦ. 6 Дец 2018, ср.википедиа.орг.


