Структура, својства и употреба берилијум оксида (БеО)
Тхе берилијум оксид (БеО) је керамички материјал који, поред своје високе чврстоће и електричне отпорности, има висок капацитет за провођење топлине што га чини дијелом нуклеарних реактора, превазилазећи чак и метале у овом посљедњем својству..
Поред своје корисности као синтетичког материјала, може се наћи иу природи, мада је ријетка. Њено управљање мора бити спроведено пажљиво, јер има способност да озбиљно оштети здравље људи.
У савременом свету, примећено је како су научници повезани са технолошким компанијама спровели истраживања за развој напредних материјала за прилично специјализоване апликације, као што су оне које су у складу са полуводичким материјалима и онима у ваздухопловној индустрији..
Резултат тога је откриће супстанци које су нам, захваљујући својим изузетно корисним својствима и њиховој високој издржљивости, дале могућност да напредујемо у времену, што нам омогућава да своју технологију пренесемо на више нивое..
Индек
- 1 Хемијска структура
- 2 Својства
- 2.1 Електрична проводљивост
- 2.2 Топлотна проводљивост
- 2.3 Оптичка својства
- 2.4 Здравствени ризици
- 3 Усес
- 3.1 Електронске апликације
- 3.2 Нуклеарне апликације
- 3.3 Остале апликације
- 4 Референце
Хемијска структура
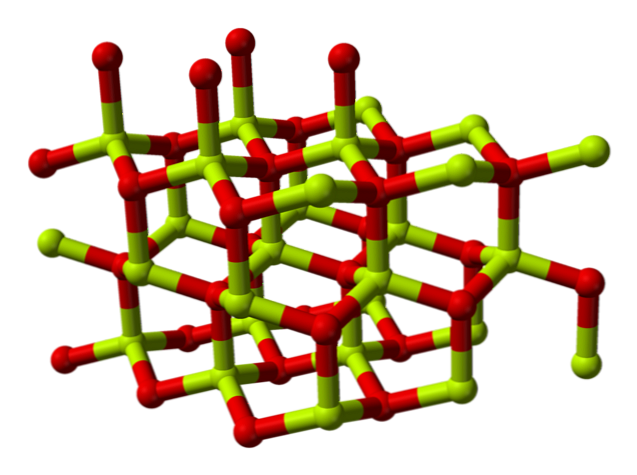
Молекул берилијум оксида (који се такође назива "Берилиа") Састоји се од атома берилијума и атома кисеоника, који су координирани у тетраедарној оријентацији и кристализира се у хексагоналним кристалним структурама званим вуртзитес.
Ови кристали имају тетраедарске центре, које заузима Бе2+ и О2-. На високим температурама структура берилијум оксида постаје тетрагонална.
Добијање берилијум оксида се постиже трима методама: калцинацијом берилијум карбоната, дехидратацијом берилијум хидроксида, или паљењем берилијумског метала. Берилијумов оксид настао на високим температурама је инертан, али се може растворити од неколико једињења.
БеЦО3 + Топлота → БеО + ЦО2 (Цалцинатион)
Бе (ОХ) \ т2 → БеО + Х2О (Дехидрација)
2 Бе + О2 → 2 БеО (паљење)
Коначно, берилијум оксид се може испарити, иу том стању ће бити представљен у облику двоатомских молекула..
Пропертиес
Берилијум оксид се јавља у природи као бромелит, бели минерал који се налази у неким сложеним наслагама мангановог гвожђа, али се чешће налази у његовом синтетичком облику: белој аморфној чврстој материји која се производи у облику праха.
Такође, нечистоће које су заробљене током производње ће дати различите боје узорку оксида.
Тачка топљења је 2507 ° Ц, тачка кључања 3900 ° Ц, а густина 3,01 г / цм3.
На исти начин, његова хемијска стабилност је знатно висока, само реагује са воденом паром на температурама близу 1000 ºЦ, и може одолети процесима редукције угљеника и нападима растопљених метала на високим температурама..
Поред тога, његова механичка чврстоћа је пристојна и може се побољшати дизајном и производњом погодном за комерцијалну употребу.
Електрична проводљивост
Берилијум оксид је веома стабилан керамички материјал, и због тога има прилично висок електрични отпор што га чини једним од најбољих електричних изолационих материјала, заједно са алуминијум оксидом.
Због тога се овај материјал најчешће користи за специјализовану високофреквентну електричну опрему.
Топлинска проводљивост
Берилијумов оксид има велику предност у погледу његове топлотне проводљивости: познат је као други најбољи топлотно-проводни материјал међу неметалима, који је прекорачен само дијамантом, материјал знатно скупљи и ријетки..
Што се тиче метала, само бакар и сребро преносе топлоту боље од проводљивости него берилијум оксид, што га чини веома пожељним материјалом.
Због својих одличних својстава топлотне проводљивости, ова супстанца је укључена у производњу ватросталних материјала.
Оптичка својства
Због својих кристалних особина, берилијум оксид се користи за наношење транспарентног материјала на ултраљубичасто зрачење у одређеним равним екранима и фотонапонским ћелијама.
Исто тако, могу се произвести кристали врло високог квалитета, тако да се ова својства побољшавају у складу са кориштеним производним процесом.
Здравствени ризици
Берилијумов оксид је једињење које се мора пажљиво третирати, јер прво поседује карциногена својства, која су повезана са континуираним удисањем праха или пара овог материјала..
Мале честице у овим фазама оксида приањају на плућа, и могу генерисати настанак тумора или болест познату као берилиоза..
Берилиоза је болест са средњом стопом смртности која узрокује неефикасно дисање, кашаљ, губитак тежине и грозницу, и формирање гранулома у плућима или другим погођеним органима..
Постоји и опасност по здравље од директног контакта берилијум оксида са кожом, јер је корозивна и иритантна и може проузроковати оштећење површине коже и слузокоже. Дисајне путеве и руке треба штитити при раду са овим материјалом, посебно у облику праха.
Усес
Употреба берилијум оксида се углавном дели на три: електронске, нуклеарне и друге примене.
Електронске апликације
Могућност преношења топлоте на висок ниво и добра електрична отпорност учинили су да берилијум оксид добије велику корисност као хладњак.
Његова употреба је доказана у круговима у рачунарима високог капацитета, поред опреме која управља великим струјама.
Берилијум оксид је транспарентан за рендгенске и микроталасне пећи, тако да се користи у прозорима против ових типова зрачења, као и антене, комуникационе системе и микроталасне пећнице..
Нуклеарне апликације
Његова способност да ублажава неутроне и одржава своју структуру под бомбардовањем зрачења је довела до укључивања берилијум оксида у изградњу нуклеарних реактора, а може се применити иу високотемпературним реакторима хлађеним гасовима.
Остале апликације
Мала густина берилијум оксида изазвала је интересовање у индустрији ваздухопловства и војне технологије, јер може представљати опцију мале тежине у ракетним моторима и непробојним прслуцима..
Коначно, недавно је примењен као ватростални материјал у фузији метала у металуршкој индустрији.
Референце
- ПубЦхем. (с.ф.). Берилијумов оксид. Преузето са пубцхем.нцби.нлм.них.гов
- Реаде. (с.ф.). Бериллиа / Берилиј оксид (БеО). Рецоверед фром реаде.цом
- Ресеарцх, Ц. (с.ф.). Берилијев оксид - Берилија. Преузето са азом.цом
- Сервицес, Н.Ј. (с.ф.). Берилијумов оксид. Добављено из њ.гов
- Википедиа. (с.ф.). Берилијумов оксид. Преузето са ен.википедиа.орг


