Структура, својства, употреба, токсичност, карбон тетрахлорид (ЦЦл4)
Тхе тетраклорид угљеника То је безбојна течност, благо слатког мириса, слична мирису етра и хлороформа. Његова хемијска формула је ЦЦл4, и она чини ковалентно и испарљиво једињење, чија је паре веће густине од ваздуха; Није погодан за електричну енергију нити је запаљив.
Налази се у атмосфери, ријекама, мору и седиментима морске површине. Сматра се да је угљенични тетраклорид присутан у црвеним алгама синтетизован од стране истог организма.
У атмосфери се производи реакцијом хлора и метана. Индустријски произведен угљиков тетраклорид улази у океан, углавном кроз сучеље море-зрак. Процијењено је да је његов атмосферски проток => оцеански 1,4 к 1010 г / год, што је еквивалентно 30% укупног угљен тетраклорида атмосфере.
Индек
- 1 Главне карактеристике
- 2 Структура
- 3 Физичка и хемијска својства
- 4 Усес
- 4.1 Хемијска производња
- 4.2 Производња расхладних средстава
- 4.3 Сузбијање ватре
- 4.4 Чишћење
- 4.5 Хемијска анализа
- 4.6 Инфрацрвена спектроскопија и нуклеарна магнетна резонанца
- 4.7 Растварач
- 4.8 Друге употребе
- 5 Токсичност
- 5.1 Хепатотоксични механизми
- 5.2 Токсични ефекти на бубрежни систем и централни нервни систем
- 5.3 Ефекти изложености људи
- 5.4 Токсичне интеракције
- 6 Интермолекуларне интеракције
- 7 Референце
Главне карактеристике
Угљен тетраклорид се индустријски производи термалним хлорисањем метана, при чему метан реагује са гасом хлора на температури између 400 ° Ц и 430 ° Ц. Током реакције добија се сирови производ, са споредним производом хлороводоничне киселине.
Такође је индустријски произведен методом угљен-дисулфида. Хлор и угљен дисулфид реагују на температури од 90 ° Ц до 100 ° Ц, користећи гвожђе као катализатор. Затим се сиров производ подвргава фракционисању, неутрализацији и дестилацији.
Тхе ЦЦл4 има вишеструку употребу, између осталог: растварач масти, уља, лакова, итд.; хемијско чишћење одеће; пестициди, у пољопривредној и фунгицидној фумигацији и производњи најлона. Међутим, упркос великој корисности, његова употреба је делимично искључена због високе токсичности.
Код људи изазива токсичне ефекте на кожу, очи и респираторни тракт. Али најштетнији ефекти се јављају у функционисању централног нервног система, јетре и бубрега. Оштећење бубрега је можда главни узрок смрти који се приписује токсичном дејству тетраклорида угљеника.
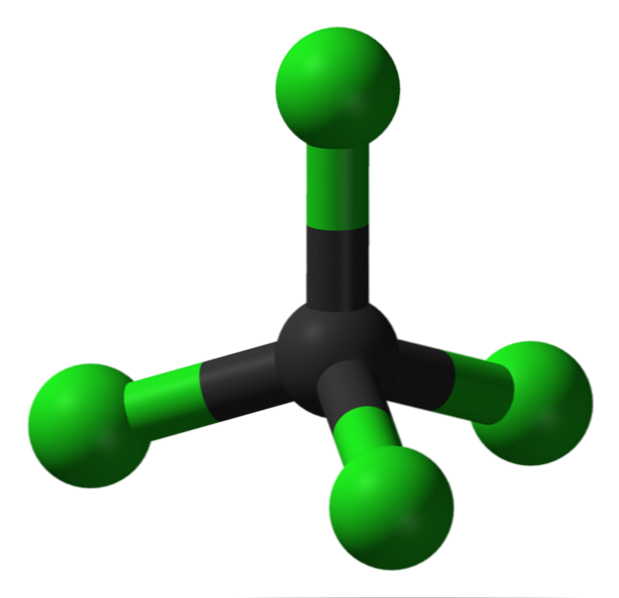
Структура
На слици можете видети структуру тетраклорида угљеника, која је тетраедарска геометрија. Треба приметити да су атоми Цл (зелене сфере) оријентисани у простору око угљеника (црна сфера) цртањем тетраедра.
Такође, вреди поменути да су сви врхови тетраедра идентични, структура је симетрична; то јест, није важно како се ротира ЦЦл молекул4, Увек ће бити исто. Онда, од зеленог тетраедра ЦЦл-а4 је симетрично, има за последицу одсуство сталног диполног момента.
Зашто? Јер, иако су везе Ц-Цл поларне због веће електронегативности Цл у односу на Ц, ови моменти се поништавају векторски. Према томе, то је аполарно хлорисано органско једињење.
Угљен је потпуно хлорисан у ЦЦл-у4, оно што је једнако високој оксидацији (угљеник може да формира максимално четири везе са хлором). Овај растварач не тежи да изгуби електроне, апротичан је (нема водоника), и представља средство за транспорт и мало складиштење хлора..
Физичке и хемијске особине
Формула
ЦЦл4
Молекуларна тежина
153,81 г / мол.
Физички изглед
То је безбојна течност. Кристализира се у облику моноклинских кристала.
Мирис
Представља карактеристични мирис присутан у другим хлорисаним растварачима. Мирис је ароматичан и помало сладак, сличан мирису тетраклоретилена и хлороформа..
Тачка кључања
170.1 ºФ (76.8 ºЦ) до 760 ммХг.
Тачка топљења
-9ºФ (-23ºЦ).
Растворљивост у води
Слабо је растворљив у води: 1.16 мг / мЛ на 25ºЦ и 0.8 мг / мЛ на 20ºЦ. Зашто? Зато што вода, високо поларни молекул, не "осећа" афинитет према тетраклориду угљеника, који је аполаран.
Растворљивост у органским растварачима
Због симетрије његове молекуларне структуре, угљен тетраклорид је неполарно једињење. Због тога се он може мешати са алкохолом, бензеном, хлороформом, етром, угљен-дисулфидом, петролеј етром и нафтом. Исто тако, раствара се у етанолу и ацетону.
Густина
У течном стању: 1.59 г / мл на 68 ° Ф и 1.594 г / мл на 20 ° Ц.
У чврстом стању: 1.831 г / мл на -186 ° Ц и 1.809 г / мл на -80 ° Ц.
Стабилност
Генерал инерт.
Корозивно дјеловање
Напада неке облике пластике, гуме и премаза.
Тачка паљења
Сматра се да није лако запаљиво, што указује на тачку паљења као мање од 982 ºЦ.
Аутоматско паљење
982 ° Ц (1200 К).
Густина паре
5.32 у односу на ваздух, узима се као референтна вредност једнака 1.
Притисак паре
91 ммХг на 68 ° Ф; 113 ммХг на 77 ºФ и 115 ммХг на 25 ºЦ.
Децомпоситион
У присуству пожара формира хлорид и фосген, јако токсично једињење. Исто тако, под истим условима он се разлаже у хлороводоник и угљен моноксид. У присуству воде на високим температурама може изазвати хлороводоничну киселину.
Вискозност
2.03 к 10-3 Па · с
Праг мириса
21.4 ппм.
Индекс рефракције (ηД)
1,4607.
Усес
Хемијска производња
-Делује као агенс за хлорисање и / или као растварач у производњи органског хлора. Исто тако, интервенише као мономер у производњи најлона.
-Делује као растварач у производњи гуменог цемента, сапуна и инсектицида.
-Користи се у производњи хлорофлуороугљичног пропеланта.
-Без Ц-Х веза, угљен тетраклорид не пролази кроз реакције слободним радикалима, па је он користан растварач за халогенације, било елементарним халогеном или халогенационим реагенсом, као што је Н-бромосукцинимид..
Производња расхладних средстава
Коришћен је у производњи хлорофлуороугљеника, расхладног средства Р-11 и трихлорофлуорометана, расхладног средства Р-12. Ова расхладна средства уништавају озонски омотач, због чега су препоручили престанак њихове употребе, према препорукама Монтреалског протокола..
Сузбијање ватре
Почетком двадесетог века, угљен тетраклорид почео је да се користи као апарат за гашење пожара, заснован на скупу својстава једињења: он је хлапљив; његова пара је тежа од ваздуха; Није електрични проводник и није лако запаљив.
Када се загреје, угљен тетраклорид постаје тешка пара која покрива продукте сагоревања, изолујући их од присутног кисеоника у ваздуху и узрокујући да угаси пожар. Погодан је за борбу против нафтних пожара и уређаја.
Међутим, на температурама изнад 500 ° Ц, угљен тетраклорид може реаговати са водом, изазивајући фосген, токсично једињење, тако да се мора обратити пажња на вентилацију током употребе. Поред тога, може реаговати експлозивно са металним натријумом, избегавајући његову употребу у пожарима уз присуство овог метала.
Чишћење
Угљен тетраклорид се користи у хемијском чишћењу одеће и других материјала за употребу у домаћинству. Осим тога, користи се као индустријски одмашћивач метала, одличан за растварање масти и уља.
Хемијска анализа
Користи се за детекцију бора, бромида, хлорида, молибдена, волфрама, ванадијума, фосфора и сребра.
Инфрацрвена спектроскопија и нуклеарна магнетна резонанца
-Користи се као растварач у инфрацрвеној спектроскопији, јер угљен тетраклорид нема значајну апсорпцију у тракама> 1600 цм-1.
-Коришћен је као растварач у нуклеарној магнетној резонанци, јер није ометао технику јер није поседовао водоник (апротичан је). Али због своје токсичности, и због тога што је његова моћ растварача ниска, угљен тетраклорид је замењен деутерираним растварачима..
Солвент
Карактеристика постојања неполарног једињења омогућава употребу тетраклорида угљеника као растварача за уља, масти, лакове, лакове, гумене воскове и смоле. Такође може да раствори јод.
Отхер усес
-То је важна компонента у лава лампама, јер због своје густине угљен тетраклорид додаје тежину воску.
-Користи се сакупљачима печата, јер открива водене жигове на маркицама без оштећења.
-Користи се као пестицид, фунгицид и прскање зрна како би се елиминисали инсекти.
-У процесу резања метала користи се као мазиво.
-Користи се у ветеринарској медицини као антхелминтик у лечењу фасциолазе, изазване Фасциола хепатица код оваца.
Токсичност
-Угљен тетраклорид се може апсорбовати кроз респираторне, дигестивне, окуларне и кожне путеве. Гутање и удисање су веома опасни јер могу узроковати дуготрајно тешко оштећење мозга, јетре и бубрега.
-Контакт са кожом изазива иритацију и дугорочно може изазвати дерматитис. Док контакт са очима изазива иритацију.
Хепатотоксични механизми
Главни механизми који узрокују оштећење јетре су оксидативни стрес и промјена хомеостазе калција..
Оксидативни стрес је неравнотежа између производње реактивних врста кисеоника и способности тела да генерише редукциону околину, унутар њихових ћелија, која контролише оксидативне процесе.
Неравнотежа у нормалном редокс стању може изазвати токсичне ефекте због производње пероксида и слободних радикала који оштећују све компоненте ћелија.
Угљен тетраклорид се метаболише продукцијом слободних радикала: Цл3Ц. (радикал трихлорометил) и Цл3ЦОО. (радикал трихлорометилпероксид). Ови слободни радикали производе липопероксидацију, која узрокује повреде јетре и плућа.
Слободни радикали такође изазивају руптуру плазма мембране ћелија јетре. Ово производи повећање цитосолне концентрације калцијума и смањење интрацелуларног механизма секвестрације калцијума.
Интрацелуларно повећање калцијума активира ензим фосфолипазу А2 који делује на фосфолипиде мембране, погоршава њену афекцију. Поред тога, постоји инфилтрација неутрофила и хепатоцелуларне повреде. Постоји смањење ћелијске концентрације АТП и глутатиона које узрокује ензимску инактивацију и смрт ћелија.
Токсични ефекти у бубрежном систему и централном нервном систему
Токсични ефекти угљеничног тетраклорида се манифестују у бубрежном систему са смањењем продукције акумулације урина и воде у телу. Посебно у плућима и повећање концентрације метаболичког отпада у крви. Ово може изазвати смрт.
На нивоу централног нервног система долази до учешћа аксоналне проводљивости нервних импулса.
Ефекти изложености људи
Кратко трајање
Иритација очију; ефекти на јетру, бубрег и централни нервни систем, могу довести до губитка свијести.
Лонг дуратион
Дерматитис и могућа канцерогена активност.
Токсичне интеракције
Постоји повезаност између многих случајева интоксикације са угљен тетраклоридом и конзумирањем алкохола. Претјеран унос алкохола узрокује оштећење јетре, што у неким случајевима доводи до цирозе јетре.
Примећено је да се токсичност тетраклорида угљеника повећава са барбитуратима, јер они имају сличне токсичне ефекте.
На пример, на нивоу бубрега, барбитурати смањују излучивање урина, а ово дејство барбитурата је слично токсичном дејству тетраклорида угљеника на функцију бубрега.
Интермолекуларне интеракције
Тхе ЦЦл4 Може се сматрати као зелени тетраедар. Како је у интеракцији са другима?
Будући да је аполарни молекул, без сталног диполног момента, не може да ступа у интеракцију са дипол-диполом. Да би држали своје молекуле заједно у течности, атоми хлора (врхови тетраедара) морају на неки начин међусобно дјеловати; и успели су захваљујући дисперзионим снагама Лондона.
Електронски облаци Цл атома се крећу, и за кратке тренутке, стварају богате и сиромашне области електрона; то јест, они стварају тренутне диполе.
Богато подручје електрона δ- узрокује да се атом Цл сусједне молекуле поларизира: Цлδ-δ+Цл, дакле, два Цл атома могу се држати заједно током ограниченог времена.
Али, имају милионе молекула ЦЦл4, интеракције постају довољно ефикасне да формирају течност под нормалним условима.
Поред тога, четири Цл повезана ковалентно са сваким Ц значајно повећавају број ових интеракција; толико, да ври на 76.8ºЦ, високој тачки кључања.
Тачка кључања ЦЦл4 не може бити виша јер су тетраедре релативно мале у поређењу са другим неполарним једињењима (као што је ксилен, који ври на 144ºЦ).
Референце
- Хардингер А. Стевен. (2017). Илустрован речник органске хемије: Угљен тетраклорид. Преузето са: цхем.уцла.еду
- Сви Сииавула. (с.ф.). Интермолекуларне и интератомске снаге. Преузето са: сииавула.цом
- Цареи Ф.А. (2006). Органиц Цхемистри (Шесто издање). Мц Грав Хилл.
- Википедиа. (2018). Угљен тетраклорид. Преузето са: ен.википедиа.орг
- ПубЦхем. (2018). Царбон Тетрацхлориде. Преузето са: пубцхем.нцби.нлм.них.гов
- Цхемицал Боок. (2017). Угљен тетраклорид. Преузето са: цхемицалбоок.цом


