Основе, својства и недостаци теорије мора електрона
Тхе електронска теорија електрона То је хипотеза која објашњава изузетан хемијски феномен који се јавља у металним везама између елемената са ниским електронегативностима. Ради се о подели електрона између различитих атома повезаних металним везама.
Електронска густина између ових веза је таква да се електрони делокализирају и формирају "море" гдје се слободно крећу. Може се такође изразити квантном механиком: неки електрони (обично један до седам по атому) распоређени су у орбитале са вишеструким центрима који су растегнути преко металне површине.
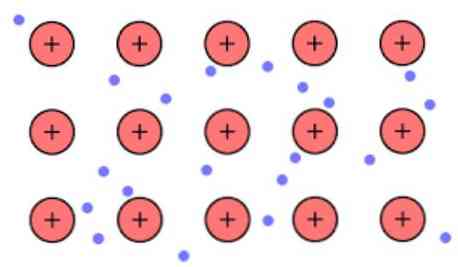
Такође, електрони задржавају неку локацију у металу, мада дистрибуција вероватноће електронског облака има већу густину око неких специфичних атома. То је због чињенице да при примени одређене струје они показују своју проводљивост у одређеном правцу.
Индек
- 1 Основе теорије о мору електрона
- 2 Својства
- 2.1 Оффсет у облику слојева
- 2.2 Теорија мора електрона у металним кристалима
- 3 Недостаци теорије
- 4 Референце
Основе теорије о мору електрона
Метални елементи имају велику тенденцију да донирају електроне са њиховог последњег енергетског нивоа (валентни слој), због њихове ниске јонизације енергије у односу на друге елементе..
Знајући то, сваки метални елемент се може сматрати катионом који је повезан са електроном његовог последњег енергетског нивоа, који би био склонији даровању.
Пошто у металу имате велики број атома који су међусобно повезани, можете претпоставити да тај метал формира групу металних катјона који су уроњени у неку врсту мора валентних електрона који имају велики оффсхоринг..
Узимајући у обзир да електростатичке силе привлачења које постоје између катиона (позитивног набоја) и електрона (негативног набоја) имају снажно повезане атоме метала, он замишља делокализацију валентних електрона који се понашају као електростатички адхезив који задржава везу на металне катионе.
На овај начин, може се закључити да што је већи број електрона присутних у валентном слоју метала, ова врста електростатичког лепка ће имати већу чврстоћу..
Пропертиес
Теорија о мору електрона нуди једноставно објашњење карактеристика металних врста као што су отпорност, проводљивост, дуктилност и савитљивост, које варирају од једног метала до другог..
Откривено је да је отпорност на метале последица велике делокализације њихових електрона, која генерише веома високу кохезиону силу између атома који га формирају.
На овај начин, дуктилност је позната као способност одређених материјала да допусте деформацију њихове структуре, без да се довољно издвоје да се сломе, када се подвргну одређеним силама.
Оффсхоринг у облику слојева
И дуктилност и савитљивост метала одређени су чињеницом да су валентни електрони делокализирани у свим правцима у облику слојева, што их доводи до тога да се крећу један изнад другог под дјеловањем вањске силе, избегавање ломљења металних конструкција, али дозвољава његову деформацију.
Исто тако, слобода кретања делокализованих електрона дозвољава да постоји проток електричне струје, што чини метале веома добру проводљивост електричне енергије.
Поред тога, овај феномен слободног кретања електрона омогућава пренос кинетичке енергије између различитих региона метала, који промовише пренос топлоте и проузрокује високу топлотну проводљивост метала..
Теорија мора електрона у металним кристалима
Кристали су чврсте супстанце које имају физичке и хемијске особине - као што су густина, тачка топљења и тврдоћа - које се утврђују врстом сила које чине честице које их чине да остану заједно.
На неки начин, сматра се да кристали металног типа имају најједноставније структуре, јер је свака "тачка" кристалне мреже заузета атомом самог метала..
У том истом смислу, утврђено је да је структура металних кристала генерално кубична и фокусирана на лицима или телу.
Међутим, ове врсте могу бити шестерокутног облика и имају прилично компактно паковање, што им даје да је огромна густина која је карактеристична.
Због овог структурног разлога, везе које се формирају у металним кристалима разликују се од оних које се јављају у другим врстама кристала. Електрони који могу да формирају везе су делокализовани кроз кристалну структуру, као што је горе објашњено.
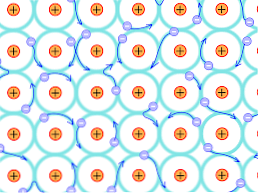
Недостаци теорије
У металним атомима постоји мала количина валентних електрона пропорционално њиховим енергетским нивоима; то јест, постоји већа количина расположивих енергетских стања од количине повезаних електрона.
То имплицира да, пошто постоји јака електронска делокализација и енергетски опсези који су делимично попуњени, електрони се могу кретати кроз ретикуларну структуру када су изложени електричном пољу које долази споља, поред формирања океана електрона. који подржава пропусност мреже.
Тако се унија метала тумачи као конгломерат позитивно наелектрисаних јона спојених морем електрона (негативно набијеним).
Међутим, постоје карактеристике које се не објашњавају овим моделом, као што је формирање одређених легура између метала са специфичним саставима или стабилност колективних металних веза, између осталих..
Ови недостаци су објашњени квантном механиком, јер су и ова теорија и многи други приступи успостављени на основу најједноставнијег модела једног електрона, док се покушавају применити много сложеније структуре мултиелектронских атома..
Референце
- Википедиа. (2018). Википедиа. Преузето са ен.википедиа.орг
- Холман, Ј.С., анд Стоне, П. (2001). Цхемистри Преузето са боокс.гоогле.цо.ве
- Паркин, Г. (2010). Метал-Метал Бондинг. Преузето са боокс.гоогле.цо.ве
- Рохрер, Г. С. (2001). Структура и везивање у кристалним материјалима. Преузето са боокс.гоогле.цо.ве
- Ибацх, Х., и Лутх, Х. (2009). Физика чврстог стања: увод у принципе науке о материјалима. Преузето са боокс.гоогле.цо.ве


