Формуле натријум сулфида, употреба, ризици
Тхе натријум сулфид (На2С) је кристална чврста материја од жуте до црвене боје. У природи се налази у различитим степенима хидратације, најчешће је натријум сулфид нонахидрат (На2С · 9Х2О).
То су соли растворљиве у води које дају јако алкалне растворе. Када су изложени влажном ваздуху, они апсорбују влагу из ваздуха, која може спонтано да се загреје и изазове паљење околних запаљивих материјала. Исто тако, у контакту са влажним ваздухом, испуштају водоник-сулфид, који мирише на покварена јаја.

Они су јаки редукциони агенси. Ове супстанце могу бити опасне за животну средину, посебно за водене организме.
Натријум моносулфид је комерцијално доступан у облику пахуљица које садрже 60-62% На2С ...
- Формуле

- ЦАС: 1313-82-2 Натријум сулфид (анхидровани)
- ЦАС: 1313-84-4 Натријум сулфид (нонахидратед)
2Д струцтуре
3Д струцтуре
Карактеристике натријум сулфида
Физичке и хемијске особине

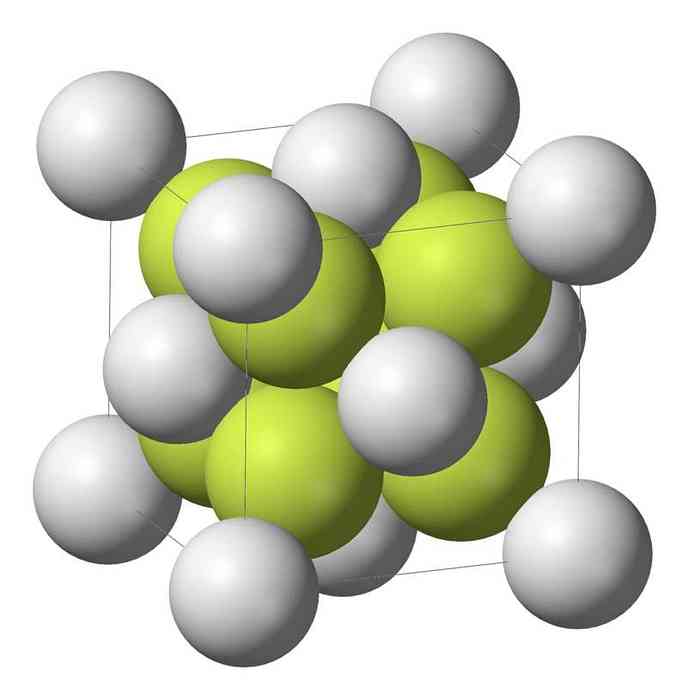
Натријум моносулфид (На2С) кристализује са антифлуоритном структуром, у којој је сваки атом С окружен коцком од 8 На атома и сваки На атом тетраедром од 4 С атома..
Запаљивост
Једини високо запаљиви члан у групи неорганских сулфида је сумпороводик. Међутим, неки други неоргански сулфиди, као што је натријум сулфид, могу спонтано да се загреју и чак запале ако су изложени влази..
Када је изложен ватри, натријум сулфид испушта гасове или паре сумпор диоксида, који су иритантни или токсични.
Реактивност
- Неоргански сулфиди су генерално базични (неки су јако базични и због тога нису компатибилни са киселинама).
- Многа од ових једињења су редукциона средства (реагују снажно са оксидационим агенсима).
- Једноставне соли сулфида (као што су натријум, калијум и амонијум сулфид) реагују енергично са киселинама да би се ослободио високо токсичан и запаљив гас водоник сулфида.
- Натријум сулфид је запаљив. Може експлодирати када се брзо загреје или удари.
- Када се загреје до распадања, емитује токсичне паре натријум оксида и оксида сумпора.
- Бурно реагује са угљеником, угљем, диазонијум соли, Н, Н-дихлорометиламином, јаким оксидансима и водом.
Токсичност
Многи чланови групе неорганских сулфида понашају се као јаке базе и могу изазвати тешке опекотине када дођу у контакт са кожом.
Ово својство зависи од његове растворљивости. Неотопљени неоргански сулфиди (на пример, живин (ИИ) сулфид и кадмијум сулфид) нису каустични.
Натријум сулфид има медијум коефицијента расподеле октанол / вода (Пов) (-3,5). Ова вредност се користи као мера растворљивости (и биоконцентрације) супстанце у животињским масним ткивима (посебно воденим животињама).
Сматра се да је натријум сулфид опасан за животну средину, посебно за водене организме.
Усес
Код куће, натријум сулфид се користи у откривању цеви, средстава за чишћење у домаћинству (за пећ, купатило), средстава за равнање косе, сапуна за суђе и ауто ваздушних јастука..
У индустрији се користи у средствима за чишћење, у цементу и као прекурсор у производњи других хемијских производа.
Клинички ефекти
Излагање натријум сулфиду је уобичајено у развијеним земљама и неразвијеним земљама, како у индустрији тако и код куће. Ове корозивне супстанце присутне су у неколико производа за домаћинство у ниској концентрацији.
У развијеним земљама озбиљни ефекти су ретки. До њих долази углавном због намерног уноса хемикалије код одраслих. Међутим, у земљама у развоју, озбиљнији ефекти су чешћи.
Алкалне корозивне твари узрокују некрозу услијед укапљивања. Сапонификује масти у ћелијској мембрани, уништавајући ћелију и омогућавајући дубоку пенетрацију у ткиво слузокоже.
Орална изложеност
Иницијална упала се јавља у гастроинтестиналном ткиву, након чега слиједи некроза ткива (уз могућу перфорацију), затим гранулација и коначно формирање стенозе..
Пацијенти са благим гутањем развијају иритацију или опекотине степена И (површинска хиперемија и едем) орофаринкса, једњака или желуца.
Пацијенти са умјереном интоксикацијом могу развити опекотине ИИ степена (површински пликови, ерозије и улцерације) са могућим даљњим формирањем стенозе (посебно езофагеалне)..
Неки пацијенти (посебно мала деца) могу развити едем у горњем респираторном тракту.
Пацијенти са тешком интоксикацијом гутањем могу развити дубоке опекотине и некрозу слузнице гастроинтестиналног тракта, са компликацијама као што су: перфорација (езофагеална, гастрична, ретко дуоденална), формирање фистуле (трахеоезофагеална, аортоезофагеална) и гастроинтестинално крварење.
Могу се развити: хипотензија, тахикардија, тахипнеја, формација стриктуре (углавном езофагеалне), карцином једњака и едеми горњег респираторног тракта (који је чест и често опасан по живот).
Озбиљно тровање је углавном ограничено на намерне уносе код одраслих.
Излагање удисањем
Благо излагање може изазвати кашаљ и бронхоспазам.
Јако удисање може изазвати едем горњих дисајних путева, опекотине, стридор и, ретко, акутну повреду плућа..
Излагање очију
Може изазвати тешку иритацију коњунктивала и хемозу, дефекте епитела рожњаче, лимбичку исхемију, трајни губитак вида и тешке случајеве перфорације..
Дермално излагање
Блага изложеност изазива иритацију и парцијалне опекотине. Код пацијената са тешким опекотинама или шоком може доћи до метаболичке ацидозе.
Продужено излагање или производи високе концентрације могу изазвати опекотине укупне дебљине.
Безбедност и ризици
Изјаве о опасностима глобално хармонизованог система за класификацију и означавање хемикалија (ДГУ)
Глобално хармонизовани систем за класификацију и означавање хемикалија (ДГУ) је међународно усаглашен систем, који су направили Уједињени народи и који је замењен различитим стандардима класификације и означавања који се користе у различитим земљама коришћењем конзистентних критеријума широм света..
Класе опасности (и одговарајуће поглавље ГХС-а), стандарди класификације и обележавања и препоруке за натријум сулфид су следећи (Европска агенција за хемикалије, 2017, Уједињене нације, 2015, ПубЦхем, 2017):







Референце
- Бењах-бмм27, (2006). Флуорите-унит-целл-3Д-иониц [имаге] Добављено из: википедиа.орг.
- ЦхемИДплус, (2017). 1313-82-2 [имаге] Добављено из: цхем.нлм.них.гов.
- ЦхемИДплус, (2017). 3Д структура 1313-82-2 - натријум сулфид [имаге] Добављено из: цхем.нлм.них.гов.
- ЦхемИДплус, (2017). 3Д структура 1313-84-4 - натријум сулфид [имаге] Добављено из: цхем.нлм.них.гов.
- Европска агенција за хемикалије (ЕЦХА). (2017). Сажетак класификације и означавања.
- Хармонизована класификација - Анекс ВИ Уредбе (ЕЗ) бр. 1272/2008 (Уредба ЦЛП). Натријум сулфид. Преузето 16. јануара 2017., са: ецха.еуропа.еу.
- Европска агенција за хемикалије (ЕЦХА). (2017). Сажетак класификације и означавања.
- Пријављена класификација и означавање. Натријум сулфид, хидриран. Преузето 16. јануара 2017., са: ецха.еуропа.еу.
- Банка података о опасним супстанцама (ХСДБ). ТОКСНЕТ (2017). Натријум сулфид. Бетхесда, МД, ЕУ: Национална медицинска библиотека. Преузето са: токнет.нлм.них.гов.
- Ланге, Л., & Триебел, В. (2000). Сулфиди, полисулфиди и сулфани. У Уллманн-овој Енциклопедији индустријске хемије. КГаА. Вилеи-ВЦХ Верлаг ГмбХ & Цо. Преузето са дк.дои.орг.
- Уједињене нације (2015). Глобално хармонизовани систем за класификацију и означавање хемијских производа (ДГУ) Шесто ревидирано издање. Њујорк, Сједињене Државе: публикација Уједињених нација. Преузето са: унеце.орг.
- Национални центар за биотехнолошке информације. ПубЦхем Цомпоунд Датабасе. (2016). Содиум Сулфиде еннеахидрате - ПубЦхем Струцтуре [имаге] Добављено из: пубцхем.нцби.нлм.них.гов.
- Национални центар за биотехнолошке информације. ПубЦхем Цомпоунд Датабасе. (2017). Натријум моносулфид. Бетхесда, МД, ЕУ: Национална медицинска библиотека. Преузето са: пубцхем.нцби.нлм.них.гов.
- Национални центар за биотехнолошке информације. ПубЦхем Цомпоунд Датабасе. (2017). Содиум Сулфиде еннеахидрате. Бетхесда, МД, ЕУ: Национална медицинска библиотека. Преузето са: пубцхем.нцби.нлм.них.гов.
- Национална администрација за океане и атмосферу (НОАА). ЦАМЕО Цхемицалс. (2017). Цхемицал Датасхеет. Натријум сулфид, безводни. Силвер Спринг, МД. ЕУ; Преузето са: цамеоцхемицалс.ноаа.гов.
- Национална администрација за океане и атмосферу (НОАА). ЦАМЕО Цхемицалс. (2017). Реацтиве Гроуп Датасхеет. Сулфиди, неоргански. Силвер Спринг, МД. ЕУ; Преузето са: цамеоцхемицалс.ноаа.гов.
- Ондреј Мангл, (2007). Сулфид содны - На2С [имаге] Добављено из: википедиа.орг.
- ПубЦхем, (2016). Натријум моносулфид [имаге] Добављено из: пуцхем.нлм.них.гов.
- ПубЦхем, (2016). Содиум Сулфиде еннеахидрате [имаге] Добављено из: пуцхем.нлм.них.гов.
- Википедиа. (2017). Коефицијент октанол-вода. Преузето 17. јануара 2017., са: википедиа.орг.
- Википедиа. (2017). Натријум сулфид. Преузето 17. јануара 2017., са: википедиа.орг.


