Карактеристике раствора, разлике у растворима и растварачу, Примери
Тхе солуте, у решењу,то је супстанца која се раствара у растварачу. Генерално, растворена материја се налази у мањој мери и може бити чврста, течна или гасовита. Напротив, растварач је компонента отопине која је у већој количини.
На пример, у сланој води, сол је раствор и вода је растварач. Међутим, нису све растворене супстанце чврсте или су растварачи течни.

У том смислу, постоји неколико могућих комбинација растворених материја и растварача: гас у течности, гас у чврстом стању, течност у течности, течност у чврстом, чврсто у течном или чврстом стању.
Да би се препознало оно што је раствор у решењу треба узети у обзир два аспекта. Прво, раствор је супстанца која је у мањем проценту. Поред тога, то је оно које мења своје физичко стање (чврсто, течно или гасовито) када је интегрисано у решење.
Индек
- 1 Раствори, растварачи и раствори
- 2 Дефиниција раствора
- 3 Карактеристике
- 3.1 Растворљивост
- 3.2 Температура
- 3.3 Засићење решења
- 3.4 Притисак
- 3.5 Поларитет
- 4 Разлике између раствора и растварача
- 5 Примери раствора
- 5.1 Солути у гасном стању
- 5.2 Солути у чврстом стању
- 5.3 Солути у течном стању
- 5.4 Солути који се могу користити код куће
- 6 Референце
Раствори, растварачи и раствори
У хемији постоје хомогене мешавине, које су по својим садржајем подељене у једнаке пропорције. Једна од најчешћих врста хомогених смеша су раствори, који су стабилне хомогене смеше две или више супстанци, где се раствор раствара у растварачу.
Решења, растварачи и раствор се посматрају у свакодневним ситуацијама иу распону који варира од индустријске до лабораторијске. Ове супстанце формиране из смеша су предмети проучавања због карактеристика које представљају и сила и / или атракција које се појављују између њих..
Дефиниција раствора
Као што је горе наведено, раствор је та супстанца која се раствара у другу, која се назива растварач.
Обично раствор има мању пропорцију и може се појавити у било којем од три стања материје. Када је дато решење између две супстанце које су у истој фази, методом избора који се користи у мањем проценту се користи за дефинисање који је раствор и који је растварач.
Капацитет растварања растворене материје биће регулисан растворљивошћу. Температура растварача такође представља одлучујући фактор када је у питању могућност да се формира или не добије раствор, с обзиром да што је виша температура растварача, то је већа количина растворене материје која се може растворити.
Постоје супстанце које се називају површински активне твари које постају мање топљиве на вишим температурама, али су изузеци и испуњавају одређене улоге.
Процес у којем растварач ступа у интеракцију са раствореном супстанцом да би се формирао раствор дефинише се као солватација, и укључује формирање веза и водоничних мостова, поред атракција ван дер Ваалсових сила..
Феатурес
Растворене супстанце садрже огромну разноликост хемијских супстанци у различитим стањима, имају различите капацитете растварања и имају бројне карактеристике које играју важну улогу у формирању хомогених смеша. Неке од главних карактеристика растворених материја су следеће:
Растворљивост
Растворљивост је способност једињења да се раствори у другој супстанци. Ова способност има блиску везу са мешањем, која је способност течности да се меша са специфичним; Ако не можете да се придружите, то је немерљивост.
Мјешавина има опсег већи од одређеног броја, тако да се може рећи да је једна супстанца потпуно, делимично или не мешљива у другој.
Растворљиво својство растворене супстанце зависи на друге факторе који могу повећати или смањити овај капацитет услед дејства ових на равнотежу интермолекуларних сила које се стварају између растворене материје и растварача.
Чак и мање очекиване карактеристике, као што је величина капи раствора или ред у структури кристала, могу утицати на њихову способност растварања.
Температуре
Температура система у коме се раствор може растворити може да утиче на његову растворљивост: за већину чврстих материја и течности, они повећавају капацитет растварања према повећању температуре.
Насупрот томе, у гасовима је примећено комплексно понашање које је приказано као нижа растворљивост у води при вишим температурама, али већа у органским растварачима.
Засићење отопине
То се назива засићење решења до степена у коме је раствор растворио раствор, назван засићеним раствором за оно што је растворено што је више могуће растворене материје. Од тог тренутка, додата раствор ће се таложити као вишак на дну коришћеног контејнера; пре тога, раствор се назива незасићен.
Могуће је проћи тачку засићења и наставити растапати растворену материју, али то захтијева повећање температуре. Раствор који садржи вишак растворене материје и који је загрејан назива се презасићеним раствором.
Притисак
Промене притиска обично не утичу на растворљивост чврстих материја и течности, изузев неких изузетних случајева (акумулација калцијум сулфата у петролејским цевима), али у гасовима то је одлучујући фактор њихове способности растварања.
У ствари, растворљивост гаса у растварачу је директно пропорционална парцијалном притиску тог гаса на поменутом растварачу.
Поларитет
Поларитет растворене материје је пресудан када се мери његов капацитет растварања; раствор ће се боље растворити у растварачу са хемијском структуром сличном оној коју има.
На пример, високо поларне или хидрофилне супстанце ће имати већу растворљивост у високо поларним растварачима, док ће оне бити практично нерастворљиве у неполарним супстанцама..
Слично томе, интермолекуларне силе играју важну улогу у солватацији и лакоћи са којом растварач може растворити раствор: веће дипол-диполске силе, водоничне везе и друге везе, већа способност растварача да се раствори раствор и формира раствор.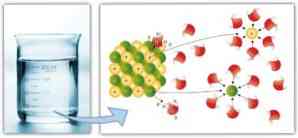
Разлике између раствора и растварача
- Раствор је супстанца која се раствара; растварач је средство за растварање раствора (а).
- Раствор је у чврстој, течној или гасној фази; растварач је обично у течној фази, али такође постоји у чврстом и гасовитом стању.
- Растворљивост растворене материје више зависи од својстава као што је површина; Капацитет солвата зависи од поларитета, температуре и притиска, између осталих фактора.
- Раствор је обично жељена компонента која се екстрахује у индустријским процесима; Растварач обично није жељена компонента и одбацује се у индустријским процесима.
Примери раствора
- Шећер је пример чврсте фазе раствора, која се обично користи за заслађивање воде.
- Хексан се може наћи у парафинском воску, служећи као течна растворна супстанца која чини ову чврсту супстанцу још мекшом.
- Угљен-диоксид је гас који се додаје у напитке како би се добило пјенушавост.
Раствара се у гасовитом стању
Угљен диоксид у води (безалкохолна пића)
Угљенична вода је вода која садржи угљен-диоксид и настаје преношењем угљен-диоксида под притиском кроз воду.
Газиране минералне воде настају природно дуго времена. Ове шумеће воде постоје због вишка угљен-диоксида у водоноснику који је растворен под притиском.
Један од најпознатијих примера растворених материја су комерцијална безалкохолна пића, која се комбинују са сирупом.
Присуство угљен диоксида чини ове воде и безалкохолна пића привлачнијим и визуелно привлачнијим.
Кисеоник и други гасови у азоту (ваздуху)
Ваздух у атмосфери се састоји од молекула различитих гасова. У основи се састоји од 78% азота и око 21% кисеоника. Поред тога, садржи скоро 1% аргона и других молекула, али у врло малим количинама.
Пропан у бутану (гас за кување)
Ова комбинација, позната и као течни нафтни гас (ЛПГ), почела је да се користи од 1860. године као извор горива за кућне потребе..
Од тада је проширила своју производњу и потрошњу за домаћу и индустријску употребу. Пошто су оба гаса екстремно без мириса и опасна, додаје се супстанца која се зове меркаптан, која чини свако цурење видљиво..
Раствара се у чврстом стању
Бакар цинк (месинг) \ т
Комерцијална легура позната као месинг је формирана од цинка (од 5 до 40%) раствореног у бакру. Цинк помаже повећању затезне чврстоће. Осталим елементима као што су коситар, гвожђе, алуминијум, никал и силициј могу се додати ове легуре.
Јод у алкохолу (тинктура јода)
Још један примјер популарне супстанце је јодна тинктура. Овај раствор садржи јод у етил алкохолу (од 44 до 50%). Јодна тинктура се користи као антисептик.
Со у води (морска вода)
Морска вода покрива више од 70% површине Земље. То је сложена смеша од 96,5% воде, 2,5% соли и мањих количина других супстанци. То укључује неорганске и растворене органске материјале, честице и неке атмосферске гасове.
Раствара се у течном стању
Алкохол у води (алкохолна пића)
Етанол или етилни алкохол (растопљена супстанца) из ферментације шећера се мешају са водом у фиксним пропорцијама за производњу алкохолних пића.
Ово једињење се лако пробавља у организму, али његова потрошња у вишку може проузроковати озбиљно оштећење здравља.
Вода у ваздуху (влажност у ваздуху)
Вода у ваздуху је обично позната као магла. Ово је узроковано малим капљицама воде суспендиране у зраку, и то је у основи због хлађења Земље током ноћи.
На овај начин ово хлађење доводи до смањења температуре околног ваздуха. Затим се јавља феномен када се у томе задржава кондензована вода.
Сирћетна киселина у води (сирће)
Оцат је течност са оштрим укусом који се користи за додавање укуса или очување хране. Припрема се помоћу раствора сирћетне киселине помешане са водом.
Концентрација сирћетне киселине је променљива. На пример, дестиловани оцат има пропорцију која иде од 5 до 8%.
Меркур у сребру (амалгами или зубне пломбе)
Амалгами који се користе за зубне пломбе формирају 2% живе са легуром која делује као растварач. Ова легура садржи 70% сребра. Можете додати и коситар, бакар и цинк.
Солутос који се може користити код куће
Шећер у води
Шећер је молекуларно и поларно једињење и као такво има способност да се раствори у води, која је такође поларни елемент.
Начин на који је шећер структуриран ће проузроковати промену процеса растварања. На пример, ако је шећер у квржицама, потребно је више времена да се раствори него ако је у зрну.
Неки стручњаци сматрају да је вода са шећером веома важан извор енергије за тело. Постоје чак и студије које откривају ефикасност овог решења код људи који раде физичку активност.
Шећер у брашну
Уобичајено је за припрему колача да прво измијешају чврсте састојке, а затим да се додају течности.
Шећер је раствор који је причвршћен за брашно, што доводи до базне мешавине за колач. Поред ова два састојка, други се додају касније, као што су јаја, путер или ванилија.
Ова врста растворене материје је чврста и, у овом случају, она је помешана са растварачем који је такође чврст. Добијена база се може користити и за прављење слатких крухова, колача, колача, колача од спужва, малих пудинга и многих других слатких намирница..
Сок у праху у води
Постоји велики број прашкастих сокова који се припремају растварањем овог елемента у води. У овом случају раствор је сок у праху, а растварач је вода.
Количина растварача мора бити већа од количине растворене супстанце, тако да се обично једна или две кашике праха сока растворе у чаши воде. Чак постоје и неки прахови чија је концентрација већа и треба користити мању количину.
Постоје клеветници ових сокова, јер они указују на то да су компоненте које садрже (као конзерванси, стабилизатори и заслађивачи, између осталог) штетне по здравље.
Хлор у води
Један од начина за пречишћавање воде је употреба хлора као раствореног раствора у води. Овај дезинфекционо средство карактерише се као један од најчешће коришћених за елиминисање микроба, и идеално је да се вода за пиће претвори у питку на брз, економичан и лак начин..
Хлор као раствор овог раствора треба уградити у воду у концентрацији не већој од 0,2 и 0,5 милиграма по литру.
Количина хлора који се користи треба да буде веома ниска, јер ова супстанца може бити екстремно токсична када се конзумира или је изложена многим количинама.
Ова метода прочишћавања воде је позната као хлоринација и може се примијенити усред екскурзије на планину или третирати воду у кући, како би се елиминисале бактерије и микроби који се могу наћи у цијевима кроз које пролази вода..
Сликање у води
Вода је универзални растварач који постоји, а то је и основа на којој се може растворити раствор као што је боја.
Боја се обично раствара из различитих разлога. Најчешћи је да се олакша чишћење четки и других алата који се користе за бојење.
Постоје многе врсте слика; Оне које се најбоље растварају у води су оне са латексом. Поред тога што омогућава боље чишћење алата, предност разблаживања боје у води пре почетка фарбања је да ће гарантовати бољу завршну обраду на обојеној површини..
Млечни прах у води
Млечни прах је раствор који настаје дехидрацијом млека које је већ пастеризовано. Сврха овог процеса је да осигура да се млијеко може дуже складиштити.
Ова растворена супстанца се раствара у води и ствара течно млеко које се обично узима за доручак, заједно са кафом или у различитим препаратима.
Као и код сокова у праху, количина млека које треба разриједити мора бити мања од количине воде у којој желите припремити отопину..
Детерџент у води
Приликом прања одјеће користе се текући или прашкасти детерџенти. Они се растварају у води да би формирали раствор који делује као дезинфекционо средство и средство за чишћење текстилних тканина.
Количина растворене материје која се мора користити у овом раствору је променљива, у зависности од врсте детерџента, презентације истог и компоненти које има.
Решење које се састоји од детерџента и воде може бити веома загађујуће када дође у контакт са воденим депонијама, тако да је препоручљиво користити биоразградиве детерџенте, који се могу разградити у врло кратком времену и утицати много мање на околину..
Желатин
Желатин је елемент састављен од тетива, лигамената и животињских костију. Ово једињење може бити у праху или у листовима.
У оба случаја, ова раствор се мора растворити у врућој води да би се постигао коначни резултат: слатка храна идеална за десерт и са многим здравственим предностима.
Међу предностима овог једињења је то што погодује брзом поправку ткива и представља антиинфламаторну храну. Поред тога, има велику количину протеина и игра важну улогу у утврђивању имунолошког система.
Једење дневне количине желатина помоћи ће регенерацију зглобова и на тај начин предвидјети појаву остеопорозе..
Чоколада у млеку
Чоколада је елемент који се формира захваљујући мешавини какаа и какао маслаца. Ова храна функционише као растворена материја када се помеша са млеком да би се припремило оно што се обично назива топла чоколада.
За овај препарат загрева се жељена количина млека и додаје се чоколада, у комадима, у праху или течности, уз стално мешање.
Да би се ова супстанца растворила на најбољи могући начин и избегла грудвице, неопходно је да се мјешавина пребије без паузе.
Какао прах у води
Можете припремити и врућу чоколаду користећи какао прах. Ова растворена супстанца настаје само од масе прашкастог какаа. За разлику од чоколаде, какао не садржи маслац овог воћа.
Какао се може савршено растопити у води да би се добило пиће са окусом чоколаде. У тим случајевима је неопходно засладити смешу шећером, медом или неким заслађивачем; у супротном, резултат ће бити изузетно горак.
Референце
- Ламберт, Н. и Мохаммед, М. (1993). Хемија за ЦКСЦ. Окфорд: Хеинеманн.
- Стеен, Д.П. (2008). Угљен диоксид, карбонација и принципи технологије пуњења. У Д. П. Стеен, Пхилип и П. Р. Асхурст (уредници), газирана безалкохолна пића: формулација и производња, стр. 112-143. Окфорд: Блацквелл Публисхинг.
- Шта је у ваздуху? (с / ф). УЦАР Центар за научно образовање. Преузето 17. октобра 2017. из ео.уцар.еду
- Течни нафтни гас. (2013, 12. јул). Енцицлопӕдиа Британница.
Преузето 16. октобра 2017. из британница.цом - Литле, Д.А. анд Сцхоцк, М.Р. (1996). Време стагнације, композиција, ПХ, и ефекти ортофосфата на излучивање метала из месинга. Охио: У.С. Агенција за заштиту животне средине.
- Црабвее, Т. Д .; Пеллетиер, С.Ј. и Пруетт, Т.Л. (2001). Сургицал Антисепсис У С. С. Блоцк (уредник), Дезинфекција, стерилизација и очување, стр. 919-934. Филаделфиа: Липпинцотт Виллиамс & Вилкинс.
- Бирне, Р.Х. ет ал. (2017., 7. јун). Морска вода. Енцицлопӕдиа Британница. Преузето 17. октобра 2017. из британница.цом
- Плутовска Б. и Варденцки, В. (2012). Гасна хроматографија-олфактометрија алкохолних пића. У Ј. Пигготт (уредник), Алцохолиц Беверагес: Сенсори Евалуатион анд Цонсумер Ресеарцх, стр.101-122. Пхиладелпхиа: Воодхеад Публисхинг.
- Шта је магла? (2017, 12. јул). Мет Оффице (УК). метоффице.гов.ук
- Хелменстине, А. М ... (2016, 16. фебруар). Шта је хемијски састав сирћета? Преузето 17. октобра 2017., из тхоугхтцо.цом
- Пхиннеи, Д.Ј. и Халстеад, Ј.Х. (2017). Стоматолошка помоћ: свеобухватни приступ. Массацхусеттс: Ценгаге Леарнинг.
- Британница, Е. (с.ф.). Солутион-Цхемистри Преузето са британница.цом
- Википедиа. (с.ф.). Растворљивост. Преузето са ен.википедиа.орг
- Цлассзоне (с.ф.). Солутес. Преузето са фрсд.к12.њ.ус
- ЦхемГуиде. (с.ф.). Засићене растворе и растворљивост. Преузето са цхем.либретектс.орг
- Мадхусха (с.ф.). Разлика између растварача и раствора. Преузето са педиаа.цом.


