Карактеристике ендотермне реакције, једначине и примери
Један ендотермна реакција то је оно што се мора одвијати да апсорбује енергију, у облику топлоте или зрачења, из околине. Генерално, иако не увек, могу се препознати по паду температуре у њиховом окружењу; или напротив, потребан им је извор топлоте, као онај који се добија од пламена који гори.
Апсорпција енергије или топлоте је оно што је заједничко свим ендотермним реакцијама; Природа истих, као и укључене трансформације, веома су разноврсне. Колико топлоте треба да апсорбују? Одговор зависи од његове термодинамике: температура на којој се реакција одвија спонтано.

На пример, једна од најзначајнијих ендотермних реакција је промена стања од леда до течне воде. Лед треба да апсорбује топлоту док температура не достигне приближно 0ºЦ; на тој температури његово топљење постаје спонтано, а лед ће се апсорбовати док се потпуно не отопи.
У врућим просторима, као што је на обалама плаже, температуре су веће и зато лед брже упија топлину; то јест, топи се на већој брзини. Отапање глечера је пример непожељне ендотермне реакције.
Зашто се тако догађа? Зашто се лед не може представити као врућа чврста маса? Одговор лежи у просечној кинетичкој енергији молекула воде у оба стања, и како они међусобно дјелују међусобно преко својих водикових веза.
У течној води, његови молекули имају већу слободу кретања него у леду, где вибрирају у својим кристалима. Да би се кретали, молекули морају апсорбовати енергију на такав начин да њихове вибрације разбијају јаке водене мостове у леду.
Из тог разлога лед апсорбује топлоту да би се растопио. Да би постојао "врући лед" водонични мостови би морали бити абнормално јаки да би се истопили на температури изнад 0 ° Ц.
Индек
- 1 Карактеристике ендотермне реакције
- 1.1 ΔХ> 0
- 1.2 Освежите околину
- 2 Екуатионс
- 3 Примери уобичајених ендотермних реакција
- 3.1 Испаравање сувог леда
- 3.2 Печење круха или кување хране
- 3.3 Сунчање
- 3.4 Реакција атмосферског азота и стварања озона
- 3.5 Електролиза воде
- 3.6 Фотосинтеза
- 3.7 Отопине неких соли
- 3.8 Термичка декомпозиција
- 3.9 Амонијум хлорид у води
- 3.10 Натријум триосулфат
- 3.11 Аутомобилски мотори
- 3.12
- 3.13 Кухање јаја
- 3.14 Кухање хране
- 3.15 Загревање хране у микроталасној пећници
- 3.16 Обликовање стакла
- 3.17 Потрошња свеће
- 3.18 Чишћење топлом водом
- 3.19 Топлинска стерилизација хране и других предмета
- 3.20 Борба против инфекција са грозницом
- 3.21 Испаравање воде
- 4 Референце
Карактеристике ендотермне реакције
Промена стања није исправна хемијска реакција; међутим, исто се дешава: производ (течна вода) има више енергије него реактант (лед). Ово је главна карактеристика реакције или ендотермног процеса: производи су енергичнији од реактаната.
Иако је то истина, то не значи да производи морају нужно бити нестабилни. У случају да јесте, ендотермна реакција престаје спонтано у свим условима температуре или притиска.
Размотримо следећу хемијску једначину:
А + К => Б
Где К представља топлоту, обично изражену јединицама џула (Ј) или калорија (кал). Пошто А апсорбује топлоту К да би се трансформисала у Б, тада се каже да је то ендотермна реакција. Дакле, Б има више енергије него А, и мора апсорбовати довољно енергије да би постигла своју трансформацију.
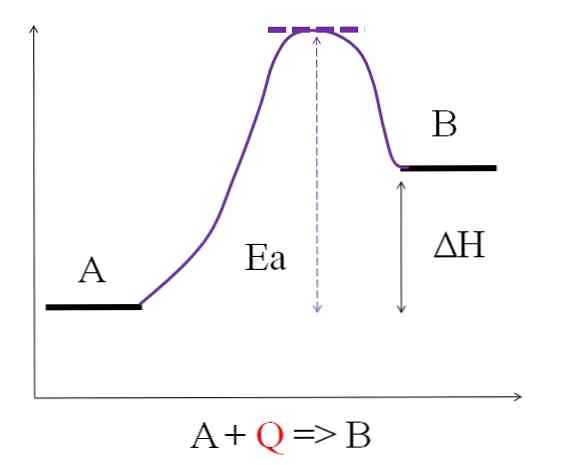
Као што се може видети на горњем дијаграму, А има мање енергије од Б. Количина топлоте К која се апсорбује А је таква да превазилази енергију активације (енергију потребну да се стигне до љубичастог врха са точкастим кровом). Енергетска разлика између А и Б је оно што је познато као енталпија реакције, ΔХ.
ΔХ> 0
Све ендотермне реакције су заједничке претходном дијаграму, јер су производи енергетски учинковитији од реактаната. Дакле, разлика енергије између њих, ΔХ, је увек позитивна (ХПродуцт-ХРеагенс > 0). Када је то истина, мора постојати апсорпција топлоте или енергије из околине за снабдевање ове енергетске потребе.
И како се такви изрази тумаче? У хемијској реакцији везе су увек прекинуте да би створиле друге. Да би их сломили, апсорпција енергије је неопходна; то јест, то је ендотермни пролаз. У међувремену, формирање веза подразумева стабилност, тако да је то егзотермни корак.
Када формиране везе не пружају стабилност која је упоредива са количином енергије која је потребна за разбијање старих веза, то је ендотермна реакција. Зато је потребна додатна енергија за промовисање разбијања најстабилнијих веза у реагенсима.
С друге стране, у егзотермним реакцијама долази до супротног: топлота се ослобађа, а ΔХ < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Хладе околину
Иако се не односи на све ендотермне реакције, неколико њих узрокује смањење температуре околине. То је зато што апсорбована топлота долази однекуд. Сходно томе, ако би се конверзија А и Б пренела у контејнер, она би се охладила.
Што је реакција ендотермнија, то ће хладњак постати контејнер и његова околина. У ствари, неке реакције су чак способне да формирају танак ледени покривач, као да су изашли из хладњака.
Међутим, постоје реакције овог типа које не охлађују своје окружење. Зашто? Зато што је топлота околине недовољна; то јест, не даје неопходан К (Ј, цал) који је написан у хемијским једначинама. Због тога, овде долази до појаве пожара или ултраљубичастог зрачења.
Између оба сценарија може доћи до мале конфузије. С једне стране, топлота околине је довољна да се реакција одвија спонтано, и посматра се хлађење; са друге стране, потребно је више топлоте и користи се ефикасан метод грејања. У оба случаја дешава се иста ствар: енергија се апсорбује.
Екуатионс
Које су релевантне једначине у ендотермној реакцији? Као што је већ објашњено, ΔХ мора бити позитиван. Да би се израчунао, прво се разматра следећа хемијска једначина:
аА + бБ => цЦ + дД
Где су А и Б реактантне супстанце, а Ц и Д су производи. Мала слова (а, б, ц и д) су стехиометријски коефицијенти. За израчунавање ΔХ ове генеричке реакције примењује се следећи математички израз:
ΔХПроизводи- ΔХРеагенси = ΔХркн
Можете наставити директно или рачунати одвојено. За ΔХПроизводи мора се израчунати следећа сума:
ц ΔХфЦ + д АХфД
Вхере ΔХф то је енталпија формирања сваке супстанце укључене у реакцију. По конвенцији, супстанце у њиховим најстабилнијим облицима имају ΔХф= 0 На пример, О молекуле2 и Х2, или чврстог метала, они имају ΔХф= 0.
Исти прорачун се сада ради за реактанте ΔХРеагенси:
то ΔХфА + б ΔХфБ
Али као што једначина каже да је ΔХРеагенси мора се одузети од ΔХПроизводи, тада се претходна сума мора помножити са -1. Дакле имате:
ц ΔХфЦ + д АХфД - (до ΔХфА + б ΔХфБ)
Ако је резултат овог израчунавања позитиван број, онда је то ендотермна реакција. А ако је негативна, то је егзотермна реакција.
Примери уобичајених ендотермних реакција
Испаравање сувог леда

Ко год је видио те бијеле паре које исијавају из колица за сладолед, свједочио је једном од најчешћих примјера ендотермне "реакције".
Поред неколико сладоледа, ови испарења одвојена од чврстог белог, названа сувим ледом, такође су била део сценарија за стварање ефекта измаглице. Овај суви лед није ништа друго него чврсти угљен диоксид, који апсорбује температуру и пре него што спољашњи притисак почне да сублимира.
Експеримент за дечју публику би био да се напуни и запечати торба са сувим ледом. После неког времена, завршиће се инфлација због ЦО2 гасовити, који ствара рад или притиска унутрашње зидове вреће на атмосферски притисак.
Печење хлеба или кување хране

Печење хлеба је пример хемијске реакције, јер сада долази до хемијских промена услед топлоте. Ко мирисе мирис свјезе пеценог круха, зна да долази до ендотермне реакције.
За тесто и све његове састојке потребна је топлота пећи да изврше све трансформације, неопходне да постану хлеб и да испоље своје типичне карактеристике.
Поред круха, кухиња је пуна примера ендотермних реакција. Тко кува са њима свакодневно. Кухање тестенина, омекшавање зрна, загревање зрна кукуруза, печење јаја, зачинско месо, печење колача, прављење чаја, грејање сендвича; свака од ових активности су ендотермне реакције.
Сунчање

Колико год једноставни и уобичајени изгледају, сунчање које неки рептили узимају, као што су корњаче и крокодили, спадају у категорију ендотермних реакција. Корњаче апсорбују топлоту сунца како би регулисале температуру свог организма.
Без сунца, они задржавају топлоту воде да би се загрејали; што доводи до хлађења воде у тенковима или рибњацима.
Реакција атмосферског азота и стварања озона

Ваздух се углавном састоји од азота и кисеоника. Током олује, ослобађа се енергија која може разбити јаке везе које држе душикове атоме заједно у Н-молекулу.2:
Н2 + О2 + К => 2НО
С друге стране, кисеоник може апсорбовати ултраљубичасто зрачење да постане озон; алотроп кисика који је веома користан у стратосфери, али штетан за живот на нивоу тла. Реакција је:
3О2 + в => 2О3
Где в значи ултраљубичасто зрачење. Механизам иза те једноставне једначине је веома сложен.
Електролиза воде
Електролиза користи електричну енергију за раздвајање молекула у његовим елементима или формирање молекула. На пример, при електролизи воде стварају се два гаса: водоник и кисеоник, сваки у различитим електродама:
2Х2О => 2Х2 + О2
Такодје, натријум хлорид може да пати од исте реакције:
2НаЦл => 2На + Цл2
У једној електроди видећете формирање металног натријума, ау другим зеленкастим мехурама хлора.
Фотосинтеза

Биљке и дрвеће морају да апсорбују сунчеву светлост као извор енергије за синтезу својих биоматеријала. За то користи ЦО као сировину2 и вода, која се кроз дуги низ корака претвара у глукозу и друге шећере. Поред тога, ствара се кисеоник који се ослобађа из листова.
Отопине неких соли
Ако је натријум хлорид растворен у води, неће се приметити приметна промена у спољашњој температури посуде или контејнера..
Неке соли, као што је калцијум хлорид, ЦаЦл2, Повећати температуру воде као производ велике хидратације Ца јона2+. И друге соли, као што је нитрат или амонијум хлорид, НХ4НО3 и НХ4Цл, смањује температуру воде и хлади околину.
У учионицама се обично раде домаћи експерименти који растварају неке од ових соли да би показали шта је ендотермна реакција.
Пад температуре је последица хидратације НХ јона4+ није фаворизован против растварања кристалних аранжмана његових соли. Сходно томе, соли апсорбују топлоту из воде да би се омогућило солватовање јона.
Друга хемијска реакција која је обично веома честа да би се то показало је следеће:
Ба (ОХ)2· 8Х2О + 2НХ4НО3 => Ба (НО3)2 + 2НХ3 +10Х2О
Обратите пажњу на количину формиране воде. Мешањем обе чврсте материје, добија се водени раствор Ба (НО3)2, са мирисом амонијака, и са таквим падом температуре који буквално замрзава спољну површину контејнера.
Тхермал децомпоситионс
Једна од најчешћих термичких декомпозиција је натријум бикарбонат, НаХЦО3, за производњу ЦО2 и воду када се загрева. Многе чврсте супстанце, укључујући карбонате, имају тенденцију да се разграде да би ослободиле ЦО2 и одговарајући оксид. На пример, распад калцијум карбоната је следећи:
ЦаЦО3 + К => ЦаО + ЦО2
Исто се дешава са карбонатима магнезијума, стронцијума и баријума.
Важно је напоменути да је термичка разградња различита од сагоријевања. У првом нема присуства паљења или ослобађања топлоте, док је у другом да; то јест, сагоревање је егзотермна реакција, иако треба да се изврши почетни извор топлоте или да се догоди спонтано.
Амонијум хлорид у води
Када се мала количина амонијум хлорида (НХ4Цл) раствори у води у епрувети, цев постаје хладнија него раније. Током ове хемијске реакције, топлота се апсорбује из околине.
Натријум триосулфат
Када кристали натријум тиосулфата (На2С2О3.5Х2О), обично назван хипо, раствара се у води, долази до ефекта хлађења.
Ауто мотори
Спаљивање бензина или дизела у моторима аутомобила, камиона, трактора или аутобуса производи механичку енергију, која се користи у промету ових возила..
Боилинг ликуидс
Стављањем течности у топлоту добија се енергија и прелази у гасовито стање.
Кухање јаја
Када се примени топлота, протеини јајета су денатурирани и формирају чврсту структуру која се обично ингестира.
Кухање хране
Генерално, увек када се кува са топлотом да би се променила својства хране, јављају се ендотермне реакције.
Ове реакције су оно што проузрокује да храна постане мекша, генерише подлозне масе, ослобађају компоненте које садрже, између осталог.
Загревање хране у микроталасној
Микроталасним зрачењем, молекули воде у храни апсорбују енергију, почињу вибрирати и повећавају температуру хране.
Моулдед гласс
Упијање топлоте стаклом чини њихове спојеве флексибилнијим, чинећи њихов облик лакшим за промену.
Потрошња свеће
Восак од свијеће се топи док упија топлину пламена, мијењајући облик.
Чишћење топлом водом
Када користите топлу воду за чишћење предмета који су замрљани машћу, као што су посуде или одећа, маст постаје течнија и лакше се уклања.
Топлинска стерилизација хране и других предмета
Када загревају објекте или храну, микроорганизми које садрже такође повећавају своју температуру.
Када се испоручује много топлоте, јављају се реакције унутар микробних ћелија. Многе од ових реакција, као што су ломљење веза или денатурација протеина, завршавају убијањем микроорганизама.
Борба против инфекција са грозницом
Када се грозница манифестује, то је зато што тело производи потребну топлоту да убије бактерије и вирусе који узрокују инфекције и генеришу болести.
Ако је генерисана топлота висока и повишена температура, ћелије тела су такође погођене и постоји ризик од смрти.
Испаравање воде
Када вода испари и претвори се у пару, то је због топлоте коју добија из околине. Како топлотна енергија добија сваки молекул воде, њена вибрациона енергија расте до тачке где се може слободно кретати, стварајући испарења.
Референце
- Вхиттен, Давис, Пецк & Станлеи. (2008). Цхемистри (8. изд.). ЦЕНГАГЕ Леарнинг.
- Википедиа. (2018). Ендотермички процес. Преузето са: ен.википедиа.орг
- Хелменстине, Анне Марие, Пх.Д. (27. децембар 2018). Примери ендотермне реакције. Преузето са: тхоугхтцо.цом
- Кхан Ацадеми. (2019). Ендотхермиц вс. егзотермне реакције Преузето са: кханацадеми.орг
- Серм Мурмсон. (2019). Шта се дешава на молекуларном нивоу током ендотермне реакције? Хеарст Сеаттле Медиа. Добављено из: едуцатион.сеаттлепи.цом
- КуимиТубе. (2013). Израчунавање енталпије реакције из енталпија формације. Преузето са: куимитубе.цом
- Куимицас.нет (2018). Примери ендотермне реакције. Преузето из:
куимицас.нет.


