Формула магнезијум хидрида, хемијска структура и својства
Тхе магнезијум хидрид (МгХ2 молекулске формуле), је хемијско једињење са садржајем у тежини водоника од 7,66%, и налази се у природи као бела кристална чврста материја. Користи се углавном за припрему других хемијских супстанци, иако је такође проучаван као потенцијални медијум за складиштење водоника.
Припада породици сланих (или јонских) хидрида, дефинисаних Х-ионом негативно набијеним. Ови хидриди се сматрају онима који настају од алкалних метала и земноалкалних метала, али у случају магнезијума (и берилијума) имају ковалентне везе, поред оних јоника који карактеришу ову фамилију хидрида.
Индек
- 1 Припрема и формула
- 2 Хемијска структура
- 3 Физичка и хемијска својства
- 3.1 Пхисицал
- 3.2 Хемикалије
- 4 Усес
- 4.1 Складиштење водоника
- 4.2 Реакције хидрогенације и дехидрогенације
- 4.3 Блато
- 4.4 Горивне ћелије
- 4.5 Транспорт и енергија
- 4.6 Алкилација
- 5 Ризици
- 5.1 Реакција са водом
- 5.2 То је пирофорно
- 6 Референце
Припрема и формула
Магнезијум хидрид се формира директном хидрогенацијом магнезијума (Мг) метала у условима високог притиска и температуре (200 атмосфера, 500 ºЦ) са МгИ катализатором.2. Његова реакција је еквивалентна:
Мг + Х2→ МгХ2
Истраживана је и производња МгХ2 на нижим температурама уз употребу нанокристалног магнезијума произведеног у кугличним млиновима.
Постоје и друге методе припреме, али оне представљају сложеније хемијске реакције (хидрогенација магнезијум-антрацена, реакција између диетилмагнезијума са литијум-алуминијум хидридом, и као производ комплекса МгХ2).
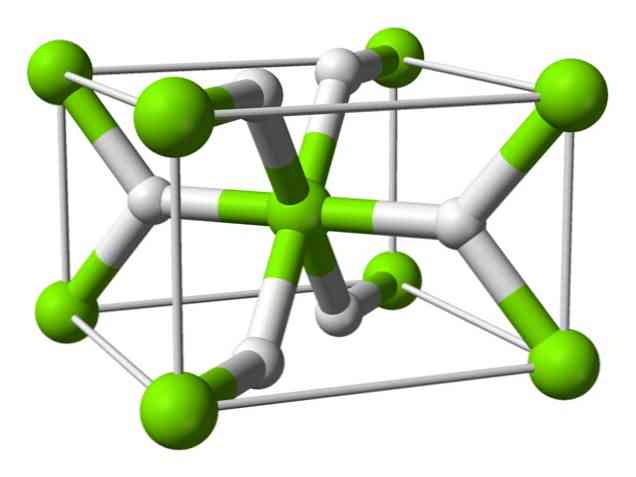
Хемијска структура
Овај атом има структуру рутила на собној температури, са тетрагоналном кристалном структуром. Има најмање четири различита облика у условима високог притиска, а такође је примећена и нестехиометријска структура са недостатком водоника; ово последње се јавља само у врло малим количинама честица када се формира.
Као што је горе поменуто, везе које постоје у рутилној структури имају делимично ковалентне особине уместо да буду чисто јонске, као и други слани хидриди.
Ово доводи до тога да атом магнезијума има сферни облик, потпуно јонизован, али његов хидридни јон има издужену структуру.
Физичке и хемијске особине
Пхисицал
- Изглед: Бијели кристали.
- Моларна маса: 26,3209 г / мол
- Густина: 1.45 г / цм3
- Тачка топљења: 285 ° Ц се распада
- Растворљивост: У води се распада.
Ово хемијско једињење има молекулску тежину од 26,321 г / мол, густину од 1,45 г / цм3 и има тачку топљења 327 ° Ц..
Цхемицалс
- Прекурсор за производњу других хемијских супстанци.
- Складиштење водоника, као могући извор енергије.
- Редукционо средство у органској синтези.
Важно је указати на то да се ово једињење не може довести у течно стање, а када се оно пренесе или тачка топљења или унесе у воду, разлаже се. Овај хидрид је нерастворљив у етру.
То је високо реактивна и лако запаљива супстанца, а такође је и пирофорна, односно може се спонтано запалити у ваздуху. Ова три услова представљају безбедносне ризике који ће бити поменути у последњем делу овог чланка.
Усес
Складиштење водоника
Магнезијум хидрид лако реагује са водом да би створио гас водоника, кроз следећу хемијску реакцију:
МгХ2+2Х2О → 2Х2+Мг (ОХ)2
Поред тога, ова супстанца се разграђује на температури од 287 ° Ц и притиску од 1 бара, као што следи:
МгХ2→ Мг + Х2
Због тога је предложена употреба магнезијум хидрида као медијума за складиштење водоника за његову употребу и транспорт.
Хидрогенација и дехидрогенација количине металног магнезијума је предложена као начин преношења количина гасовитог водоника, чиме се осигурава да нема цурења у његовом транспорту и да представља сигурнији и практичнији начин него употребом посуда високог притиска..
Реакције хидрогенације и дехидрогенације
Иако температура разлагања магнезијум хидрида представља ограничавајући фактор за његову употребу, предложене су методе за побољшање кинетике реакција хидрогенације и дехидрогенације. Једна од њих је смањење величине честице магнезијума помоћу кугличних млинова.
Блато
Поред тога, предложен је систем који производи магнезијум-хидрид у облику блата (лакше и безбедније него у праху или другим чврстим честицама), који би реаговао са водом да би се добио жељени водоник..
Процењује се да ће претходно именовани муљ бити формиран од фино мљевеног хидрида, заштићен заштитним слојем уља и суспендиран у дисперзионим агенсима како би се осигурало да задржава своју конзистенцију без губитка материјала и да не апсорбује влагу из околине..
Предност овог муља је у томе што се може пумпати преко било које уобичајене дизел, бензинске или водене пумпе, чинећи овај економски приједлог као и ефикасан.
Фуел целлс
Магнезијум хидрид се може применити у производњи напредних горивих ћелија, као иу стварању батерија и складиштења енергије.
Транспорт и енергија
Током последњих деценија разматрана је употреба водоника као извора енергије. Имплантација водоника као горива, захтева проналажење сигурних и реверзибилних система складиштења и високих запреминских капацитета (количина водоника по јединици запремине) и гравиметријске (количина водоника по јединици масе).
Алкилација
Алкилација (додавање ЦХ алкил група3Р) органских једињења у базичном медију, где је присутност -ОХ група при ниским концентрацијама и температурама вишим од тачке топљења хидрида \ т.
У овом случају, водоници присутни у магнезијум хидриду (МгХ2), споје -ОХ групе формирајући воду. Слободни магнезијум може да прими халоген који често прати молекулу алкила која се веже за ланац угљоводоника.
Ризици
Реакција са водом
Као што је већ поменуто, магнезијум хидрид је супстанца која веома лако и насилно реагује са водом, што представља способност експлозије при већим концентрацијама..
Ово се дешава зато што његова егзотермна реакција генерише довољно топлоте да упали гас водоника који се ослобађа у реакцији разлагања, што доводи до прилично опасне ланчане реакције..
То је пирофорно
Магнезијум хидрид је такође пирофоран, што значи да се може запалити спонтано у присуству влажног ваздуха, и формира магнезијум оксид и воду..
Удисање се не препоручује у чврстом стању или у контакту са парама: супстанца у свом природном стању и производи разлагања могу изазвати озбиљне повреде или чак смрт..
Може да генерише корозивна раствора у контакту са водом и контаминацију. Контакт са кожом и очима се не препоручује, а такође изазива иритацију слузокоже.
Није доказано да магнезијум хидрид може изазвати хроничне здравствене последице, као што су рак, репродуктивни дефекти или друге физичке или психичке последице, али се препоручује употреба заштитне опреме (нарочито респиратора или маски, карактер праве прашине).
Приликом рада са овом супстанцом, влажност ваздуха се мора одржавати на ниским нивоима, гасити све изворе паљења и транспортовати у бачвама или другим контејнерима за контејнере..
Увек треба избегавати рад са великим концентрацијама ове супстанце када се може избећи, јер се могућност експлозије значајно смањује.
Ако дође до изливања магнезијум хидрида, потребно је изоловати радну површину и сакупити прашину усисивачем. Никада немојте користити методу сувог чишћења; повећава шансе за реакцију са хидридом.
Референце
- Зумдахл, С.С. (1998). Енцицлопедиа Британница. Преузето са британница.цом.
- ПубЦхем. (2005). ПубЦхем Опен Цхемистри Датабасе. Преузето из пубцхем.нцби.нлм.них.гов.
- Сафе Хидроген, Л. (2006). Греен Цар Цонгресс. Преузето из греенцарцонгресс.цом.
- Цхемицалс, Ц. (н.д.). Цамео Цхемицалс. Преузето из цамеоцхемицалс.ноаа.гов.
- Сервицес, Н.Ј. (1987). Нев Јерсеи Департмент оф Хеалтх анд Сениор Сервицес. Преузето из њ.гов.


