Типови и примери молекуларне геометрије
Тхе молекуларна геометрија о молекуларна структура је просторна расподела атома око централног атома. Атоми представљају регионе у којима постоји висока електронска густина, и стога се сматрају електронским групама, без обзира на везе које формирају (једноструке, двоструке или троструке)..
Овај концепт се рађа из комбинације и експерименталних података две теорије: валентне везе (ТЕВ) и одбијања електронских парова валентне љуске (ВСПР). Док прва дефинише везе и њихове углове, друга успоставља геометрију и, према томе, молекуларну структуру.

Који геометријски облици су молекули способни за усвајање? Две претходне теорије дају одговоре. Према ВСЕПР-у, атоми и парови слободних електрона морају бити распоређени у простору тако да минимизирају електростатичко одбијање између њих..
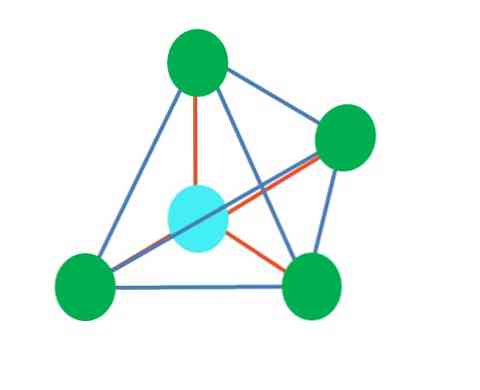
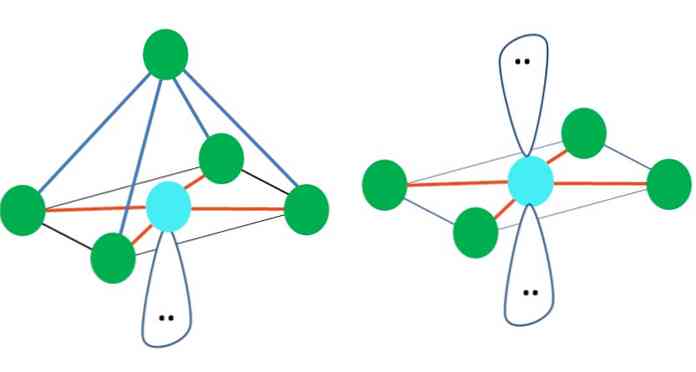
Дакле, геометријски облици нису произвољни, али тражите најстабилнији дизајн. На пример, у горњој слици лево се може видети троугао, а десно октаедар. Зелене тачке представљају атоме, а наранџасте пруге везе.
У троуглу, три зелене тачке су оријентисане у раздаљини од 120º. Овај угао, који је једнак куту везе, дозвољава атомима да се међусобно одбијају што је мање могуће. Према томе, молекул са централним атомом везаним за три друга ће усвојити тригонску геометрију.
Међутим, ВСЦР предвиђа да ће слободан пар електрона у централном атому нарушити геометрију. За случај тригоналне равни, овај пар ће гурнути три зелене тачке, што ће резултирати геометријом тригоналне пирамиде.
Исто се може догодити и са октаедром слике. У њему су сви атоми одвојени на најстабилнији могући начин.
Индек
- 1 Како унапријед знати геометрију молекула атома Кс?
- 2 Типови
- 2.1 Линеарни
- 2.2 Ангулар
- 2.3
- 2.4 Тригонал Бипирамид
- 2.5 Оцтахедрал
- 2.6 Остале геометрије молекула
- 3 Примери
- 3.1 Линеарна геометрија
- 3.2 Угаона геометрија
- 3.3 Тригонски план
- 3.4
- 3.5 Тригонална пирамида
- 3.6 тригонална бипирамида
- 3.7 Осцилирајући
- 3.8 Облик Т
- 3.9 Оцтахедрал
- 4 Референце
Како унапред сазнати геометрију молекула атома Кс?
За то је потребно узети у обзир и парове слободних електрона као електронске групе. Они ће, заједно са атомима, дефинисати оно што је познато као елецтрониц геометри, који је нераздвојни пратилац молекуларне геометрије.
Из електронске геометрије, и пошто је Левисова структура детектовала парове слободних електрона, можемо установити каква ће бити геометрија молекула. Збир свих молекуларних геометрија ће пружити преглед глобалне структуре.
Типови
Као што се види на главној слици, молекуларна геометрија зависи од тога колико атома окружује централни атом. Међутим, ако је пар електрона присутан без дељења, он ће модификовати геометрију зато што заузима много запремине. Дакле, он испољава стерички ефекат.
Према томе, геометрија може представити низ карактеристичних облика за многе молекуле. И ту се појављују различити типови молекуларне геометрије или молекуларне структуре.
Када је геометрија једнака структури? Оба означавају исто само у случајевима када структура нема више од једног типа геометрије; у супротном, морају се узети у обзир сви постојећи типови, а структури дати глобални назив (линеарни, разгранати, глобуларни, равни, итд.).
Геометрије су посебно корисне за објашњење структуре чврстог тијела из његових структурних јединица.
Линеар
Све ковалентне везе су усмерене, тако да је веза А-Б линеарна. Али да ли ће молекула АБ бити линеарна?2? Ако да, геометрија је једноставно представљена као: Б-А-Б. Два Б атома су одвојена углом од 180 °, а према ТЕВ, А мора имати сп хибридне орбитале.
Ангулар
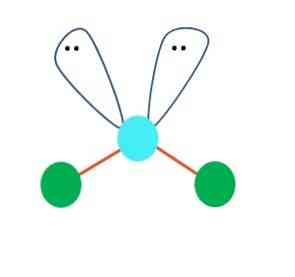
У првој инстанци се може претпоставити линеарна геометрија АБ молекуле2; међутим, од суштинског је значаја да се нацрта структура Левиса прије него што се дође до закључка. Цртањем Левисове структуре, може се идентификовати број парова електрона без дељења (:) на атому А.
Када је то тако, на врху електронских парова они гурају два атома Б, мењајући своје углове. Као резултат, линеарни молекул Б-А-Б завршава тако да постане В, бумеранг или угаона геометрија (горња слика)
Молекул воде, Х-О-Х, је идеалан пример за овај тип геометрије. У атому кисеоника постоје два пара електрона без дељења који су оријентисани под приближним углом од 109º.
Зашто овај угао? Зато што је електронска геометрија тетраедарска, која има четири врха: два за Х атоме, а два за електроне. На слици изнад наведите да зелене тачке и два "режња с очима" цртају тетраедар са плавичастом тачком у његовом средишту..
Ако О није имао слободне електронске парове, вода би формирала линеарни молекул, његов поларитет би се смањио, а океани, мора, језера итд. Вероватно не би постојали као што су познати.
Тетрахедрал
Горња слика представља тетраедралну геометрију. За молекул воде, његова електронска геометрија је тетраедарска, али елиминацијом парова без електрона може се приметити да се трансформише у угаону геометрију. Ово се такође примећује једноставно уклањањем две зелене тачке; преостала два ће нацртати В са плавом тачком.
Шта ако је уместо два пара слободних електрона постојао само један? Тада би постојала тригонална раван (главна слика). Међутим, елиминацијом електронске групе, стерички ефекат који производи пар слободних електрона није избегнут. Према томе, он изобличава тригоналну раван до троугластих базних пирамида:

Иако су тригонална и тетраедарска пирамидална молекуларна геометрија различите, електронска геометрија је иста: тетраедарска. Дакле, тригонална пирамида се не рачуна као електронска геометрија?
Одговор је не, јер је производ изобличења изазваног "режњем са очима" и његовим стеричним ефектом, а та геометрија не узима у обзир касније изобличења.
Из тог разлога, увек је важно прво одредити електронску геометрију уз помоћ Левисових структура пре дефинисања геометрије молекула. Молекул амонијака, НХ3, је пример тригоналне пирамидалне молекуларне геометрије, али са тетраедарском електронском геометријом.
Тригонал Бипирамид
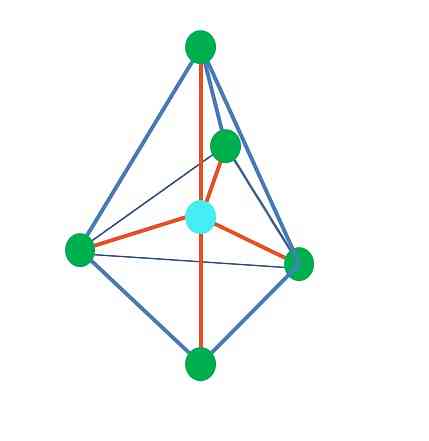
До сада, са изузетком линеарне геометрије, у тетраедарној, кутној и тригоналној пирамиди њени централни атоми имају сп хибридизацију3, према ТЕВ-у. То значи да ако су ваши углови везе одређени експериментално, они би требали бити око 109º.
Из тригоналне дипирамидалне геометрије постоји пет електронских група око централног атома. На горњој слици можете видети са пет зелених тачака; три у троугластој бази и две у аксијалним позицијама, које су горњи и доњи врх пирамиде.
Која хибридизација онда има плаву тачку? Потребно је пет хибридних орбитала да формира једноставне везе (наранџасто). То се постиже кроз пет сп орбитала3д (производ мешавине орбиталне с, три п и а д).
Када разматрамо пет електронских група, геометрија је она која је већ изложена, али имајући парове електрона без дељења, ова поново пати од дисторзија које генеришу друге геометрије. Такође, поставља се следеће питање: да ли ови парови могу заузети било који положај у пирамиди? То су: аксијални или екваторијални.
Аксијалне и екваторијалне позиције
Зелене тачке које чине троугласту основу су у екваторијалним положајима, док су две на горњем и доњем крају, у аксијалним положајима. Где ће, пожељно, бити лоциран пар електрона без дељења? У том положају минимизира електростатичко одбијање и стерички ефекат.
У аксијалном положају пар електрона би "притиснуо" окомито (90º) на троугласту основу, док би, ако би био у екваторијалној позицији, две преостале електронске групе базе биле удаљене 120º и притиснуле оба краја на 90º (уместо три, као са базом).
Дакле, централни атом ће настојати да оријентише своје парове без електрона у екваторијалним положајима да би генерисао стабилније геометрије молекула.
Осцилирајући и Т облик
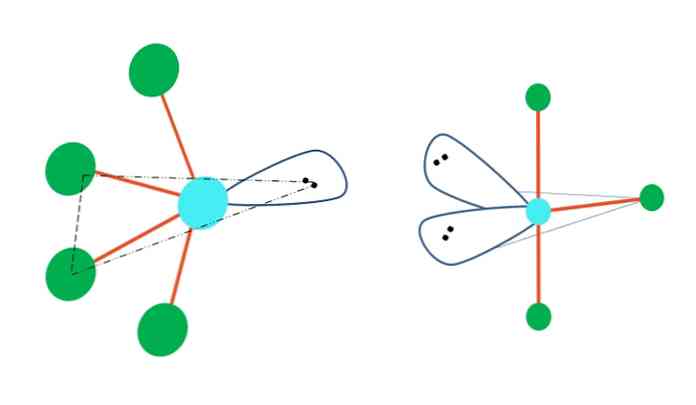
Ако би геометрија тригоналне бипирамиде заменила један или више њених атома паровима без електрона, она би такође имала различите геометрије молекула.
Са леве стране горње слике, геометрија се мења у осцилирајући облик. У њему слободни пар електрона потискује остатак четири атома у истом правцу, преклапајући своје везе на лево. Треба приметити да овај пар и два атома леже у истој троугластој равни оригиналне дипирамиде.
И десно од слике, геометрија Т-облика.Ова молекуларна геометрија је резултат замене два атома за два пара електрона, доводећи као последица тога да су преостала три атома поравната у истој равни која црта тачно једно слово Т.
Дакле, за молекул типа АБ5, усваја геометрију тригоналне бипирамида. Међутим, АБ4, са истом електронском геометријом, он ће прихватити осцилујућу геометрију; и АБ3, геометрија Т-облика.У свим њима А ће имати (генерално) сп хибридизацију3д.
Да би се одредила геометрија молекула, потребно је нацртати Левисову структуру и самим тим њену електронску геометрију. Ако је ово тригонална бипирамида, онда ће парови без електрона бити одбачени, али не и стерички ефекти на остале атоме. Дакле, могуће је савршено разликовати три могуће молекуларне геометрије.
Оцтахедрал
Октаедарска геометрија молекула је представљена десно од главне слике. Овај тип геометрије одговара АБ једињењима6. АБ4 они формирају квадратну основу, док се преостала два Б налазе у аксијалним положајима. Тако се формира неколико једнакостраничних троуглова, који су лица октаедра.
Овде, опет, могу постојати (као у свим електронским геометријама) парови слободних електрона, па стога и друге геометрије молекула потичу из те чињенице. На пример, АБ5 са октаедарском електронском геометријом састоји се од пирамиде са квадратном базом и АБ4 квадратне равни:
У случају октаедарске електронске геометрије, ове две геометрије молекула су најстабилније у погледу електростатичког одбијања. У квадратно-планарној геометрији, два електронска пара су удаљена 180 °.
Шта је хибридизација за атом А у овим геометријама (или структурама, ако је једина)? Опет, ТЕВ утврђује да је сп3д2, шест хибридних орбитала, што омогућава А да оријентише електронске групе на врховима октаедра.
Друге геометрије молекула
Модификовањем база поменутих пирамида може се добити још комплекснија молекуларна геометрија. На пример, пентагонална бипирамида се заснива на пентагону, а једињења која га формирају имају општу формулу АБ7.
Као и друге молекуларне геометрије, замена атома Б за парове без електрона ће искривити геометрију другим облицима.
Такође, АБ једињења8 они могу усвојити геометрије као што је квадрат антипризам. Неке геометрије могу бити веома компликоване, посебно за АБ формуле7 надаље (до АБ12).
Примери
Затим ће бити поменута серија једињења за сваку од главних молекуларних геометрија. Као вежбу, можете нацртати Левисове структуре за све примере и потврдити да ли, с обзиром на електронску геометрију, добијате молекуларне геометрије као што је ниже наведено..
Линеарна геометрија
-Етилен, Х2Ц≡ЦХ2
-Берилијум хлорид, БеЦл2 (Цл-Бе-Цл)
-Угљен диоксид, ЦО2 (О = Ц = О)
-Нитроген, Н2 (Н≡Н)
-Мерцури дибромид, ХгБр2 (Бр-Хг-Бр)
-Анион тријодид, И3- (И-И-И)
-Хидроген цијанид, ХЦН (Х-Н≡Ц)
Његови углови морају бити 180º, и стога имају сп хибридизацију.
Ангулар геометри
-Вода
-Сумпор диоксид, СО2
-Душиков диоксид, НО2
-Озоне, О3
-Анион амидуро, НХ2-
Тригонал плане
-Бром трифлуорид, БФ3
-Алуминијум трихлорид, АлЦл3
-Нитрат анион, НО3-
-Анион карбонат, ЦО32-
Тетрахедрал
-Метан гас, ЦХ4
-Угљен тетраклорид, ЦЦл4
-Катион амонијум, НХ4+
-Анион сулфат, СО42-
Тригонал пирамида
-Амонијак, НХ3
-Цатион хидрониум, Х3О+
Тригонал Бипирамид
-Фосфор пентафлуорид, ПФ5
-Антимон пентахлорид, СбФ5
Осциллатинг
Сумпор тетрафлуорид, СФ4
Облик Т
-Јод трихлорид, ИЦл3
-Хлорид трифлуорид, ЦлФ3 (оба једињења су позната као интерхалогени)
Оцтахедрал
-Сумпор хексафлуорид, СФ6
-Селен хексафлуорид, СеФ6
-Хексафлуорофосфат, ПФ6-
Да би кулминирала, молекуларна геометрија је оно што објашњава опажања хемијских или физичких својстава материје. Међутим, она је оријентисана према електронској геометрији, тако да се она мора увек одредити пре прве.
Референце
- Вхиттен, Давис, Пецк & Станлеи. Цхемистри (8. изд.). ЦЕНГАГЕ Леарнинг, стр. 194-198.
- Схивер & Аткинс. (2008). Неорганска хемија (Четврто издање, стр. 23, 24, 80, 169). Мц Грав Хилл.
- Марк Е. Туцкерман. (2011). Молекуларна геометрија и ВСЕПР теорија. Добављено из: ниу.еду
- Виртуал Цхембоок, Цхарлес Е. Опхардт. (2003). Увод у молекуларну геометрију. Преузето са: цхемистри.елмхурст.еду
- Цхемистри ЛибреТектс. (8. септембар 2016.) Геометри оф Молецулес. Преузето са: цхем.либретектс.орг


