Формула пропанске киселине, својства, ризици и употреба
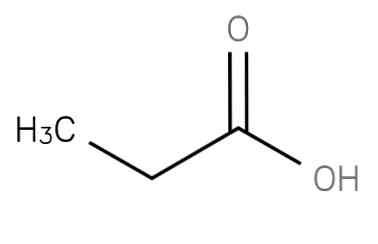
Тхе пропанска киселина "Циклоалкил" је засићена масна киселина кратког ланца која садржи етан везан за угљеник карбокси групе. Његова формула је ЦХ3-ЦХ2-ЦООХ. Анион ЦХ3ЦХ2ЦОО- као и соли и естери пропанске киселине су познати као пропионати (или пропаноати).
Може се добити из отпадне дрвне пулпе процесом ферментације користећи бактерије из рода пропионибацтериум. Такође се добија из етанола и угљен моноксида користећи катализатор бор трифлуорида (О'Неил, 2001).
Други начин добијања пропанске киселине је оксидација пропионалдехида у присуству јона кобалта или мангана. Ова реакција се убрзано развија на температурама од само 40-50 ° Ц:
2ЦХ3ЦХ2ЦХО + О2 → 2ЦХ3ЦХ2ЦООХ
Једињење је природно присутно на ниским нивоима у млечним производима и производи се у општем облику, заједно са другим масним киселинама кратког ланца, у гастроинтестиналном тракту људи и других сисара као коначни производ микробне дигестије угљених хидрата..
Има значајну физиолошку активност код животиња (Хуман Метаболоме Датабасе, 2017).
Индек
- 1 Физичка и хемијска својства
- 2 Реактивност и опасности
- 3 Биоцхемистри
- 4 Усес
- 5 Референце
Физичке и хемијске особине
Пропанска киселина је безбојна и уљана течност са оштрим, непријатним и ужеженим мирисом. Његов изглед је приказан на слици 2 (Национални центар за биотехнолошке информације, 2017).

Пропанинска киселина има молекулску масу од 74,08 г / мол и густину од 0,992 г / мл. Тачка мржњења и точка кључања су -20,5 ° Ц и 141,1 ° Ц. Пропанска киселина је слаба киселина чија је пКа 4,88.
Једињење је веома растворљиво у води, способно да раствори 34.97 грама једињења на 100 мл растварача. Такође је растворљив у етанолу, етру и хлороформу (Роиал Социети оф Цхемистри, 2015).
Пропанинска киселина има средња физичка својства између мањих карбоксилних киселина, мравље и оцтене киселине и већих масних киселина.
Он показује општа својства карбоксилних киселина и може да формира амидне, естарске, анхидридне и хлоридне деривате. Може се подвргавати алфа-халогенацији са бромом у присуству ПБр3 као катализатора (реакција ХВЗ) да би се формирао ЦХ3ЦХБрЦООХ.
Реактивност и опасности
Пропанска киселина је запаљив и запаљив материјал. Може се запалити топлотом, варницама или пламеном. Паре могу да формирају експлозивне смеше са ваздухом, да могу да путују до извора паљења и експлодирају.
Већина испарења је тежа од ваздуха. Они ће се ширити дуж земље и сакупљати у ниским или затвореним просторима (канализација, подруми, резервоари). Опасност од експлозије паре у затвореном простору, на отвореном или у канализацији.
Супстанце означене са (П) могу полимеризовати експлозивно када се загревају или пакују у ватру. Контејнери могу експлодирати приликом загријавања (ПРОПИОНИЦ АЦИД, 2016).
Једињење треба држати даље од топлоте или извора паљења. Када се загреје до распадања, испушта опипљив дим и надражујуће паре.
Пропанична киселина иритира кожу, очи, нос и грло, али не изазива акутне системске ефекте и нема видљив генотоксични потенцијал. У случају контакта треба опрати са много воде (Сигурносно-технички лист Пропионска киселина, 2013).
Биоцхемистри
Коњугирана база пропанатне киселине, пропионат, формира се као терминални фрагмент од три угљеника (активиран коензимом А као пропионил-ЦоА) у оксидацији непарних угљених масних киселина и оксидацији бочног ланца холестерол.
Експерименти са радиоактивним изотопима пропионата који су убризгавани на штакорима наташте указују на то да се може појавити у гликогену, глукози, интермедијерима циклуса лимунске киселине, амино киселинама и протеинима.
Пут метаболизма пропанске киселине укључује интеракцију са коензимом А, карбоксилацијом да би се формирао метилмалонил-коензим А, и конверзија у сукцинатну киселину, која улази у циклус лимунске киселине.
Пропанска киселина се може оксидовати без формирања тела кетона и, за разлику од сирћетне киселине, уграђена је у угљене хидрате као и липиде (Бингхам, Цохрссен, & Повелл, 2001).
Пропионска ацидурија је једна од најчешћих органских ацидурија, болест која обухвата многе различите поремећаје.
Исход пацијената рођених са пропионском киселином је слаб у обрасцима интелектуалног развоја, са 60% који имају ИК мањи од 75 и који захтевају специјално образовање..
Успешне трансплантације јетре и / или бубрега код неколико пацијената резултирале су бољим квалитетом живота, али нису нужно спречавале неуролошке и висцералне компликације.
Ови резултати наглашавају потребу за сталним праћењем метаболизма, независно од терапијске стратегије.
Усес
Пропанска киселина инхибира раст бактерија и плесни на нивоима између 0,1 и 1 теж.%. Као резултат тога, већина произведене пропанске киселине се конзумира као конзерванс за храну и храну за људску потрошњу, као што су житарице и житарице..
Очување сточне хране, житарица и хране, као и производња калцијума и пропионата који чине скоро 80% светске потрошње пропанске киселине у 2016. години, у поређењу са 78,5% у 2012. години.
Приближно 51% светске потрошње пропанинске киселине користи се за исхрану животиња и очување зрна, док се скоро 29% користи у производњи калцијум-пропионата, који се такође користе у прехрамбеној и прехрамбеној индустрији..
Друга важна тржишта за пропанску киселину су производња хербицида и диетил кетона. Примене мањег обима укључују целулоза ацетат пропионат, фармацеутске производе, естере растварача, ароме и мирисе, пластификаторе, боје и текстилне помоћне материјале, кожу и гуму.
Потражња за пропанском киселином у великој мери зависи од производње хране за животиње и житарица, а затим паковане хране и пекарских производа..
Изгледи за глобални раст пропанске киселине и њених соли у сточној храни / зрну и очувању хране су значајни (ИХС Маркит, 2016).
Остала брзо растућа тржишта укључују естере пропионата за раствараче, као што су н-бутил пропионат и пентил; Ови естри се све више користе као супститути за раствараче који су наведени као опасни загађивачи ваздуха.
Референце
- Бингхам, Е., Цохрссен, Б., & Повелл, Ц. (2001). Патти'с Токицологи Волумес 1-9 5тх ед. Нев Иорк: Јохн Вилеи & Сонс.
- ЕМБЛ-ЕБИ (2016., 14. октобар). пропионска киселина. Опорављено од ЦхЕБИ: еби.ац.ук.
- Хуман Метаболоме Датабасе. (2017, 2. март). Пропионска киселина. Добављено из хмдб.ца: хмдб.ца.
- ИХС Маркит. (2016, децембар). Цхемицал Ецономицс Хандбоок Пропионска киселина. Добављено из ихс: ихс.цом.
- Лист са подацима о безбедности материјала Пропионска киселина. (2013, мај 21). Добављено из сциенцелаб: сциенцелаб.цом.
- Национални центар за биотехнолошке информације ... (2017, 22. април). ПубЦхем Цомпоунд Датабасе; ЦИД = 1032. Преузето са пубцхем.нцби.нлм.них.гов.
- О'Неил, М. (. (2001), Тхе Мерцк Индек - Енцицлопедиа оф Цхемицалс, Другс анд Биологицалс, 13. издање, Нев Јерсеи: Мерцк анд Цо., Инц..
- ПРОПИОНИЦ АЦИД. (2016). Добављено из цамеоцхемицалс: цамеоцхемицалс.ноаа.гов.
- Краљевско хемијско друштво. (2015). Пропионска киселина. Преузето са цхемспидер: цхемспидер.цом.


