Типови, својства, номенклатура, употреба и примјери кетона
Тхе кетони они су органска једињења која поседују карбонилну групу (-ЦО). То су једноставна једињења у којима је угљеник карбонилне групе везан за два атома угљеника (и њихове супституентске ланце). Кетони су "једноставни" зато што немају реактивне групе као што су -ОХ или -Цл везани за угљеник.
Коначно, елиминација кетона из људског тела обично је повезана са ниским нивоом шећера (у случајевима дијабетеса и / или екстремним постом), што може изазвати озбиљне здравствене проблеме за пацијента..
Индек
- 1 Општа формула кетона
- 2 Врсте кетона
- 2.1 Према структури вашег ланца
- 2.2 Према симетрији његових радикала
- 2.3 Према засићењу његових радикала
- 2.4 Дикетони
- 3 Физичка и хемијска својства кетона
- 3.1 Тачка кључања
- 3.2 Растворљивост
- 3.3 Киселост
- 3.4 Реактивност
- 4 Номенклатура
- 5 Разлика између алдехида и кетона
- 6 Користи у индустријском и свакодневном животу
- 7 Примери кетона
- 7.1 Бутанон (Ц4Х8О)
- 7.2 Циклохексанон (Ц6Х10О)
- 7.3 Тестостерон (Ц19Х22О2)
- 7.4 Прогестерон (Ц21Х30О2)
- 8 Референце
Општа формула кетона
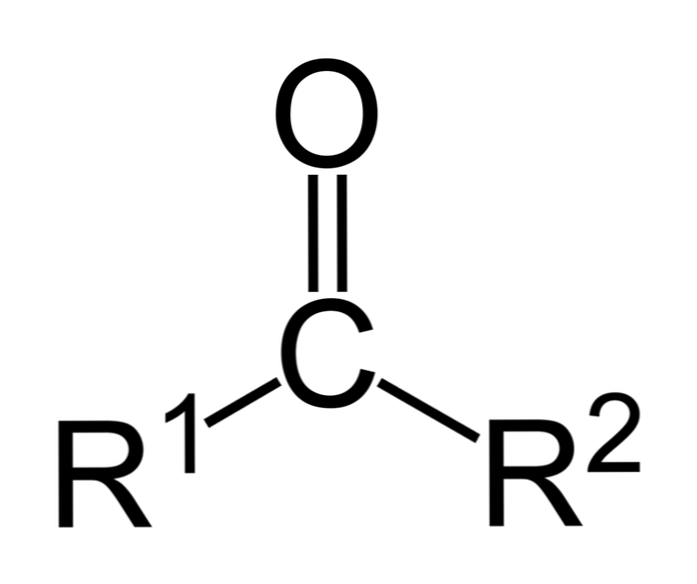
Кетони су карбонил једињења у којима је ова група везана за две угљоводоничне групе; они могу бити алкил групе, групе бензенског прстена или обе.
Кетон се једноставно може представити као Р- (Ц = О) -Р ', где су Р и Р' било која два ланца угљоводоника (алкани, алкени, алкини, циклоалкани, деривати бензена и други). Не постоје кетони са водоником везаним за карбонилну групу.
Постоји широк спектар метода за припрему кетона у индустријском и лабораторијском окружењу; Поред тога, важно је напоменути да кетони могу бити синтетизовани од стране различитих организама, укључујући људе.
У индустрији, најчешћи метод за синтезу кетона укључује оксидацију угљоводоника, типично уз употребу ваздуха. У малом обиму, кетони се обично припремају оксидацијом секундарних алкохола, који производе као кетон и воду..
Осим ових најчешћих метода, кетони се могу синтетизирати преко алкена, алкина, соли азотних спојева, естара и многих других једињења, што их чини лаким за добијање.
Врсте кетона
Постоји неколико класификација за кетоне, који зависе углавном од супституената у њиховим ланцима Р. Следеће су најчешће класификације за ове супстанце:
Према структури вашег ланца
У овом случају, кетон је класификован по начину на који је његов ланац структуриран: алифатски кетони су они који имају два радикала Р и Р 'који имају облик алкил радикала (алкани, алкен, алкини и циклоалкани)..
Са своје стране, аромати су они који формирају деривате бензена, док су и даље кетони. Коначно, мешани кетони су они који имају Р алкил радикал и Р 'арил радикал, или обрнуто.
Према симетрији његових радикала
У овом случају проучавају се радикали Р и Р 'супституенти карбонилне групе; када су они једнаки (идентични), кетон се назива симетричан; али када су различити (као и већина кетона), то се назива асиметричним.
Према засићењу његових радикала
Кетони се такође могу класификовати према засићењу њихових угљеничних ланаца; Ако су у облику алкана, кетон се назива засићени кетон. Насупрот томе, ако се ланци нађу као алкени или алкини, кетон се назива незасићени кетон.
Дицетонес
Ово је посебна класа кетона, јер ланци овог кетона имају две карбонилне групе у својој структури. Неки од ових кетона имају јединствене карактеристике, као што је дужа дужина везе између угљеника.
На пример, дикетони изведени из циклохексана познати су као кинони, који су само два: орто-бензокинон и пара-бензокинон.
Физичке и хемијске особине кетона
Кетони, као и већина алдехида, су течни молекули и имају низ физичких и хемијских својстава који варирају у зависности од дужине њихових ланаца. Његова својства су описана у наставку:
Тачка кључања
Кетони су високо испарљиви, високо поларни и не могу даровати водоник за водоничне везе (не поседују атоме водоника везаних за њихову карбонилну групу), тако да имају више тачке кључања од алкенова и етара, али ниже од оних алкохола исте молекулске тежине.
Тачка кључања кетона се повећава како се величина молекула повећава. То је због интервенције ван дер Ваалсових сила и дипол-диполних сила, које захтевају већу количину енергије за раздвајање атома и електрона привучених молекулом..
Растворљивост
Растворљивост кетона има јак утицај делимично на способност ових молекула да прихвате водоник у свом атому кисеоника и тако формирају водоничну везу са водом. Поред тога, између кетона и воде формирају се атрактивне, распршујуће и дипол-диполске силе које повећавају њихов растворљив ефекат.
Кетони губе капацитет растворљивости што је већи њихов молекул, пошто почињу да захтевају више енергије да се растворе у води. Такође су растворљиви у органским једињењима.
Киселост
Захваљујући својој карбонилној групи, кетони имају киселинску природу; то се дешава због способности резонантне стабилизације ове функционалне групе, која може пренети протоне из своје двоструке везе да би формирала коњуговану базу која се зове енол.
Реактивност
Кетони су део великог броја органских реакција; ово се дешава због осетљивости његовог карбонилног угљеника на нуклеофилну адицију, поред поларитета овог.
Као што је горе наведено, висока реактивност кетона чини их препознатим међупроизводом који служи као основа за синтезу других једињења.
Номенклатура
Кетони се називају према приоритету или важности карбонилне групе у читавом молекулу, тако да када имате молекул којим управља карбонилна група, кетон се назива додавањем суфикса "-он" на име угљоводоника..
Најдужи ланац са карбонилном групом узима се као главни ланац, а затим се именује молекул. Ако карбонилна група нема приоритет у односу на друге функционалне групе молекула, онда се она идентификује са "-око".
За компликованије кетоне, положај функционалне групе може се идентификовати са бројем, ау случају дикетона (кетони са два идентична Р и Р 'супституента), молекул са суфиксом "-дион" се назива..
Коначно, реч "кетон" се такође може користити након идентификовања ланаца радикала везаних за карбонилну функционалну групу.
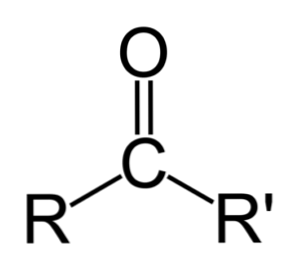
Разлика између алдехида и кетона
Највећа разлика између алдехида и кетона је присуство атома водоника везаног за карбонилну групу у алдехидима.
Овај атом има важан ефекат када је реч о укључивању молекула у реакцију оксидације: алдехид ће формирати карбоксилну киселину или сол карбоксилне киселине, у зависности од тога да ли се оксидација дешава у киселим или базичним условима..
Насупрот томе, кетон нема овај водоник, тако да се не дешавају минимални кораци неопходни за оксидацију.
Постоје методи за оксидацију кетона (са оксидационим агенсима који су много моћнији од оних који се обично користе), али они разбијају кетонски молекул, раздвајајући га прво на два или више делова..
Користи се индустријски и свакодневни живот
У индустрији се кетони често посматрају у парфемима и бојама, узимајући улоге стабилизатора и конзерванса који спречавају разградњу других компоненти смеше; они такође имају широк спектар као растварачи у оним индустријама које се баве производњом експлозива, боја и текстила, поред фармацеутских производа.
Ацетон (најмањи и најједноставнији кетон) је растварач признат у свету, и користи се као средство за уклањање боје и разређивач.
У природи, кетони се могу појавити као шећери, који се називају кетозе. Кетозе су моносахариди који садрже један кетон по молекулу. Најпознатија кетоза је фруктоза, шећер који се налази у воћу и меду.
Биосинтеза масних киселина која се јавља у цитоплазми животињских ћелија такође се јавља кроз дејство кетона. Коначно, и као што је горе наведено, може доћи до повећања кетона у крви након поста или у случајевима дијабетеса.
Примери кетона
Бутанон (Ц4Х8О)
Такође позната као МЕК (или МЕЦ), ова течност се производи у великој мери у индустрији и користи се као растварач.
Циклохексанон (Ц6Х10О)
Произведен у масивним размерама, овај кетон се користи као прекурсор синтетичког материјала од најлона.
Тестостерон (Ц19Х22О2)
То је главни хормон мушког пола и анаболички стероид који се налази у већини кичмењака.
Прогестерон (Ц21Х30О2)
Ендогени стероид и полни хормони укључени у менструални циклус, трудноћа и ембриогенеза код људи и других врста.
Референце
- Википедиа. (с.ф.). Кетоне Преузето са ен.википедиа.орг
- Британница, Е. (с.ф.). Кетоне Преузето са британница.цом
- Университи, М.С. (с.ф.). Алдехиди и кетони. Преузето са цхемистри.мсу.еду
- ЦхемГуиде. (с.ф.). Увођење алдехида и кетона. Преузето са цхемгуиде.цо.ук
- Цалгари, У. О. (с.ф.). Кетони. Преузето са цхем.уцалгари.ца


