Балансирање метода и примера хемијских једначина
Тхе балансирање хемијских једначина подразумева да сви елементи присутни у поменутој једначини имају исти број атома на свакој страни. Да би се то постигло, неопходно је користити методе балансирања за додјељивање стехиометријских коефицијената погодних за сваку врсту присутну у реакцији.
Хемијска једначина је приказивање, помоћу симбола, онога што се дешава током хемијске реакције између две или више супстанци. Реактанти ступају у међусобну интеракцију и, у зависности од услова реакције, добија се једно или више различитих једињења као производа..
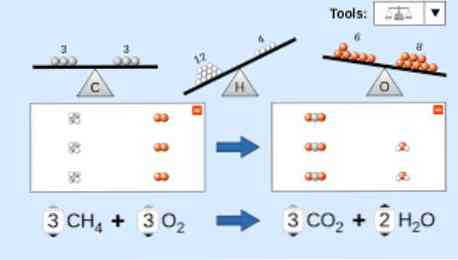
Када се описује једна хемијска једначина, мора се узети у обзир следеће: Прво, реактантске супстанце се пишу на левој страни једначине, праћене једносмерном стрелицом или двема супротним хоризонталним стрелицама, у зависности од врсте реакције која се изводи. цапе.
Индек
- 1 Методе балансирања хемијских једначина
- 1.1 Равнотежа хемијских једначина методом покушаја и грешке (такође названа инспекцијом или испитивањем)
- 1.2 Алгебарско балансирање хемијских једначина
- 1.3 Ваљање редокс једначина (јон-електронска метода)
- 2 Примери балансирања хемијских једначина
- 2.1 Први пример
- 2.2 Други пример
- 2.3 Трећи пример
- 3 Референце
Методе балансирања хемијских једначина
Узимајући као основу да су реактанти и производи познати и да су њихове формуле исправно изражене на страни која им одговара, настављамо са балансирањем једначина према следећим методама..
Балансирање хемијских једначина помоћу покушаја и грешака (које се називају и инспекцијом или испитивањем)
Она се заснива на стехиометрији реакције и покушава да покуша са различитим коефицијентима да би се балансирала једнаџба, све док се изаберу најмањи могући цели бројеви са којима се добија исти број атома сваког елемента на обе стране. реакције.
Коефицијент реактанта или производа је број који претходи његовој формули, и то је једини број који се може промијенити приликом балансирања једнаџбе, јер би промјена индекса формула промијенила идентитет споја. у питању.
Бројите и упоредите
Након што смо идентифицирали сваки елемент реакције и ставили га на исправну страну, настављамо бројати и успоређивати број атома сваког елемента присутног у једнаџби и одредити оне који морају бити уравнотежени.
Затим настављамо са балансирањем сваког елемента (један по један), стављањем целих коефицијената пре сваке формуле која садржи небалансиране елементе. Обично су метални елементи прво балансирани, затим неметални елементи и на крају атоми кисеоника и водоника.
На тај начин сваки коефицијент множи све атоме претходне формуле; тако да док балансирање елемента други могу да се дебалансирају, али то је исправљено како је реакција уравнотежена.
Коначно, поткрепљује се последњим бројем да је цела једначина исправно избалансирана, односно да се придржава закона очувања материје.
Алгебарско балансирање хемијских једначина
Да би се користио овај метод, установљена је процедура која третира коефицијенте хемијских једначина као непознате системе који се морају решити..
Прво, одређени елемент реакције се узима као референца, а коефицијенти се постављају као слова (а, б, ц, д ...), који представљају непознанице, према постојећим атомима тог елемента у сваком молекулу (ако врста не садржи тај елемент стављен "0").
Након добијања ове прве једначине, одређују се једначине за остале елементе који су присутни у реакцији; биће толико једнаџби колико има елемената у наведеној реакцији.
Коначно, непознанице се одређују једним од алгебарских метода редукције, изједначавања или супституције и добијају се коефицијенти који резултирају у правилно избалансираној једначини..
Балансирање редокс једначина (ион-елецтрон метода)
Прво се генерална (неуравнотежена) реакција ставља у њен ионски облик. Тада је ова једначина подељена на две полу-реакције, оксидацију и редукцију, свако балансирање према броју атома, њиховом типу и набоју ових.
На пример, за реакције које се дешавају у киселој средини, додају се Х молекули.2Или да балансира атоме кисеоника и дода Х+ да би уравнотежили атоме водоника.
Насупрот томе, у алкалном средству додаје се једнак број ОХ јона- на две стране једначине за сваки Х јон+, и где настају Х јони+ и ОХ- они се удружују да би формирали Х молекуле2О.
Додај електроне
Затим морате додати толико електрона колико је потребно за уравнотежење набоја, након балансирања материје у свакој полу-реакцији.
Након котрљања сваке полу-реакције, оне се додају и кулминирају балансирањем коначне једначине помоћу покушаја и грешке. У случају да постоји разлика у броју електрона у две полу-реакције, један или оба морају се помножити са коефицијентом који је једнак том броју.
Коначно, мора се поткријепити да једнаџба укључује исти број атома и истог типа атома, поред тога што имају исте набоје на обје стране глобалне једнаџбе..
Примери балансирања хемијских једначина
Први примјер
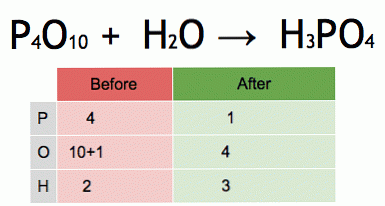
Ово је анимација уравнотежене хемијске једначине. Фосфор пентоксид и вода се претварају у фосфорну киселину.
П4О10 + 6 Х2О → 4 Х3ПО4 (-177 кЈ).
Други пример
Имате реакцију сагоревања етана (неуравнотежено).
Ц2Х6 + О2 → ЦО2 + Х2О
Користећи методу покушаја и грешке да би се балансирало, примећено је да ниједан од елемената нема исти број атома на обе стране једначине. Дакле, почиње са равнотежом угљеника, додајући два као стехиометријски коефицијент који га прати на страни производа.
Ц2Х6 + О2 → 2ЦО2 + Х2О
Угљеник је уравнотежен са обе стране, тако да настављамо да балансирамо водоник додавањем три у молекул воде.
Ц2Х6 + О2 → 2ЦО2 + 3Х2О
Коначно, будући да на десној страни једначине постоји седам атома кисеоника, а последњи елемент који је још увек уравнотежен, фракцијски број 7/2 се налази испред молекула кисеоника (иако су опште преферирани цели коефицијенти).
Ц2Х6 + 7 / 2О2 → 2ЦО2 + 3Х2О
Потом проверите да на свакој страни једначине постоји исти број атома угљеника (2), водоник (6) и кисеоник (7).
Трећи пример
Оксидација гвожђа дикроматним јонима одвија се у киселом медију (неуравнотежен и у свом јонском облику).
Фаитх2+ + Цр2О72- → Фаитх3+ + Цр3+
Користећи јон-електронску методу за њено балансирање, она је подељена у две полу-реакције.
Оксидација: Вера2+ → Фаитх3+
Редукција: Цр2О72- → Цр3+
Пошто су атоми гвожђа већ избалансирани (1: 1), на страну производа се додаје електрон да би се балансирао набој.
Фаитх2+ → Фаитх3+ + е-
Сада су атоми Цр уравнотежени, додајући два на десну страну једначине. Затим, када се реакција одвија у киселој средини, додаје се седам Х молекула.2Или на страни производа да би се уравнотежили атоми кисеоника.
Цр2О72- → 2Цр3+ + 7Х2О
Да би се уравнотежили атоми Х, додају се четрнаест Х јона+ на страни реактаната и, након изједначавања материјала, набоји су уравнотежени додавањем шест електрона на истој страни.
Цр2О72- +14Х+ + 6е- → 2Цр3+ + 7Х2О
Коначно, додају се обе полу-реакције, али пошто постоји само један електрон у реакцији оксидације, све ово мора да се множи са шест..
6Фе2+ + Цр2О72- +14Х+ + 6е- → Фаитх3+ + 2Цр3+ + 7Х2О + 6е-
Коначно, електрони морају бити елиминисани са обе стране глобалне јонске једначине, потврђујући да су њихово наелектрисање и материја правилно избалансирани.
Референце
- Цханг, Р. (2007). Цхемистри (9. издање). МцГрав-Хилл.
- Хеин, М., анд Арена, С. (2010). Основе Цоллеге Цхемистри, Алтернате. Преузето са боокс.гоогле.цо.ве
- Тули, Г.Д., и Сони, П.Л. (2016). Језик хемије или хемијске једначине. Преузето са боокс.гоогле.цо.ве
- Спееди Публисхинг (2015). Једнаџбе и одговори хемије (Спееди Студи Гуидес). Преузето са боокс.гоогле.цо.ве


