Атомски модел Далтон постулата
Тхе Далтонов атомски модел или Далтонова атомска теорија, То је био предлог који је између 1803. и 1807. године представио енглески хемичар и математичар Џон Далтон. То је био први предлог концептуалне организације у вези са структуром и функционисањем атома.
Далтонов модел је такође познат као сферни модел, јер предлаже чињеницу да је атом недељива, чврста и компактна сфера. Захваљујући овом моделу било је много лакше дати објашњење о хемији остатку свијета и то је била основа многих иновативних истраживачких пројеката који су услиједили. Може објаснити зашто су супстанце реаговале у одређеним државама.
Према Далтону, материја је била састављена од минималне јединице назване атом, која се не може уништити или поделити на било који начин. Ова јединица, коју је раније предложио Демокрит и његов ментор Леуципо, била је основа Далтоновог истраживања и стварања његовог атомског модела..
Са овом теоријом о атомима, Џон Далтон је покушао да прихвати идеје грчких филозофа о постојању атома (атомска теорија универзума), али користећи као платформу разне лабораторијске експерименте који су му омогућили да демонстрира своје идеје..
Индек
- 1 Постулати Далтонског атомског модела
- 1.1 Постулат 1
- 1.2 Постулате 2
- 1.3 Постулат 3
- 1.4 Постулате 4
- 1.5 Постулате 5
- 1.6 Постулат 6
- 2 Грешке Далтоновог атомског модела
- 2.1 Формула воде
- 2.2 Састав атома
- 3 Закључци
- 4 Далтонови главни доприноси
- 4.1 Прекурс атомских теорија
- 4.2 Поставио је темеље модерне хемије
- 4.3 Прво објавити табелу хемијских тежина
- 4.4 Дајте име слепила за боје
- 5 чланака од интереса
- 6 Референце
Постулати Далтон Атомиц Модел
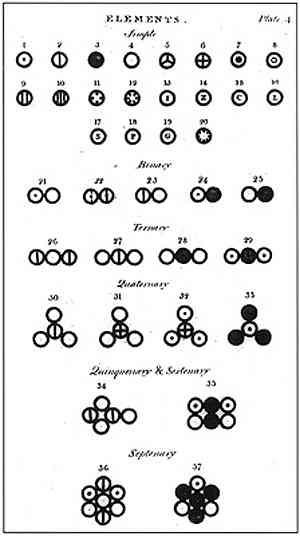
Далтон је формулисао свој атомски модел са 6 постулата у којима објашњава како је засновао своје студије и како их је извео.
Постулате 1

У горњој слици приказан је сажетак Далтоновог модела: атоми би били мале сфере недељиве, неуништиве и хомогене.
Далтонов први постулат наводи да су елементи састављени од ситних честица названих атоми, које се не могу поделити нити се могу уништити..
Такође, Далтон је рекао да те честице не могу да се промене у било којој хемијској реакцији.
Постулате 2

Други постулат Далтона је утврдио да су сви атоми присутни у истом елементу једнаки по тежини као иу другим карактеристикама.
С друге стране, утврђено је да атоми различитих елемената имају различиту масу. Из овог приједлога произашло је познавање релативних атомских тежина које су се показале при упоређивању различитих елемената с водиком.
Постулате 3

Трећи постулат Далтона показао је да су атоми недељиви чак и када се комбинују у хемијским реакцијама. Нити они могу бити створени или уништени.
Комбинација атома, једнаких и различитих, генерисаће комплекснија једињења, али овај процес неће променити чињеницу да је атом минимална јединица материје.
Постулате 4
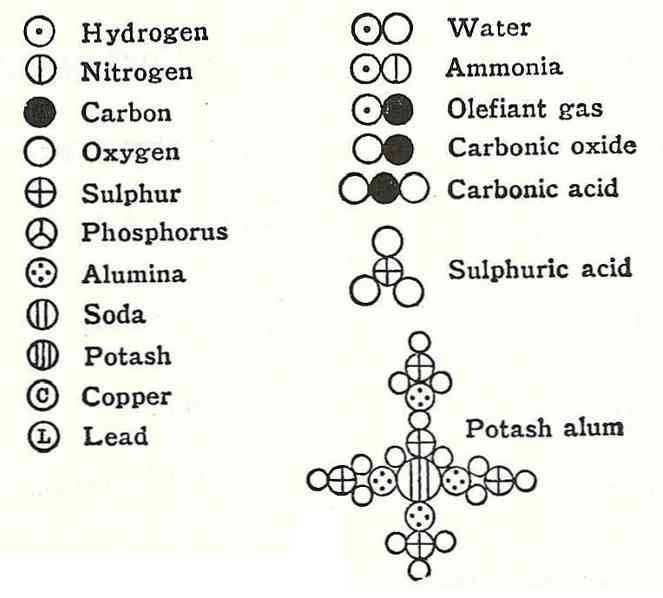
Четврти постулат Далтона је установио да чак и када се атоми комбинују да формирају једињење, они ће увек имати однос који се може изразити једноставним и потпуним бројевима. Овај израз неће бити приказан у фракцијама, јер су атоми недељиви.
Постулате 5
Далтонов пети постулат наводи да постоји могућа комбинација различитих атома у различитим пропорцијама да би се формирало више од једног једињења.
На тај начин се може објаснити да је из коначне количине атома дошла сва постојећа материја у универзуму.
Постулате 6
Далтонов шести и последњи постулат наводи да је свако хемијско једињење створено из комбинације атома два или више различитих елемената..
Грешке Далтоновог атомског модела
Као и сва теорија у свету науке, било је много оспоравања у односу на модел који је предложио Далтон, који су се показали током година остављајући иза себе иновативне идеје о Далтону..
Формула воде
Пример за то био је аргумент Далтона о формули воде, за коју је рекао да је састављен од водоника и кисеоника.
Због ове тврдње било је много грешака у прорачуну у односу на масу и тежину неких базичних једињења која су заснована на тој информацији.
Неколико година касније, европски научници Гаи-Луссац и Алекандер вон Хумбодт побили су ове информације и доказали да је вода заправо састављена од два водоника и једног кисика. 6 година касније Амадео Авогадро је истакао тачан састав воде и због тога постоји Закон о Авогадру.
Састав атома
С друге стране, у двадесетом веку откривен је прави састав атома. У овом случају је показано да постоји мања јединица као што су протони, електрони и неутрони.
Слично томе, постојање различитих атомских тежина утврђених у периодном систему Менделејева и Мејера, постојање изотопа и више специфичних хемијских својстава, дошло је до.
Закључци
Упркос његовим грешкама, прилози Џона Далтона су били од велике важности у свету науке и изазвали су узбуђење у његово време због велике количине информација које је он пружио..
Ваши научни доприноси су још увијек важећи и још увијек се проучавају.
Атомски модел Далтона деценијама није испитиван због његове релевантности у свету науке и његовог исправног објашњења истраживањима и хипотезама које су у том тренутку представљене у историји науке..
Далтонови главни доприноси
Његов допринос свету науке био је углавном да разјасни и формулише хипотезе о природи кроз квантитативне тестове.
Научник је умро од срчаног удара 27. јула 1884. године у Манчестеру и убрзо након примања почасти од монархије.
Претходник атомских теорија
Џон Далтон био је енглески хемичар, математичар и хемичар. Рођен је 6. септембра 1766. у Цумберланду, у Великој Британији, и познат је као један од претеча атомских теорија од тренутка када је представио свој атомски модел..
Он је поставио темеље модерне хемије
Далтон је познат као један од претходника у креирању табеле релативних тежина за хемијске елементе. Ова чињеница је помогла да се постави основа онога што данас знамо као модерну хемију.
Прво објавити табелу хемијских тежина
Далтон је био први научник који је имао част да објави табелу атомских тежина које укључују елементе као што су водоник, кисеоник, фосфор, угљеник и сумпор. Захваљујући овој публикацији Далтон је почео да ради и да обликује свој атомски модел.
Дајте име слепила за боје
Треба напоменути да је Далтон био један од првих људи који су се регистровали са визуелним проблемима да би ухватили боје и због њега се ово стање назива слепило за боје.
Чланци од интереса
Атомски модел Шредингера.
Атомски модел Броглие.
Атомски модел Цхадвицка.
Атомски модел Хеисенберга.
Атомски модел Перрина.
Атомски модел Тхомсона.
Атомски модел Дирац Јордан.
Атомски модел Демокрита.
Атомски модел Бохра.
Референце
- Далтонова атомска теорија. Преузето 24. новембра 2017. из Кханацадеми: ввв.кханацадеми.орг
- Далтонова атомска теорија. Преузето 24. новембра 2017. године, са Универзитета Индиана Нортхвест: иун.еду
- Атомиц тхеори. Преузето 24. новембра 2017. из Енцицлопӕдиа Британница: ввв.британница.цом
- Атомиц Тхеори. Преузето 24. новембра 2017., из Википедије: ен.википедиа.орг
- Историја атомске структуре. Преузето 24. новембра 2017., из Лумен: цоурсес.луменлеарнинг.цом.


