Тубулина Алфа и Бета, Функције
Тхе тубулин је глобуларни димерни протеин формиран са два полипептида: тубулин алфа и бета. Они су организовани у облику епрувете да би се добиле микротубуле, које заједно са актиним микрофиламентима и средњим филаментима чине цитоскелет..
Микротубуле се налазе у различитим битним биолошким структурама, као што су флагелум сперме, екстензије треперавих организама, цилија трахеје и јајоводе, између осталих..
Поред тога, структуре које формирају тубулину функционишу као транспортни правци-аналози до трагова влакана материјала и органела унутар ћелије. Измештање супстанци и структура је могуће захваљујући моторним протеинима везаним за микротубуле, које се називају кинезин и динеин.
Индек
- 1 Опште карактеристике
- 2 Тубулин алфа и бета
- 3 Функције
- 3.1 Цитоскелетон
- 3.2 Митоза
- 3.3 Центросоме
- 4 Еволуцијска перспектива
- 5 Референце
Опште карактеристике
Подјединице тубулина су хетеродимери од 55.000 далтона и грађевни блокови микротубула. Тубулин се налази у свим еукариотским организмима и веома је конзервиран у току еволуције.
Димер се састоји од два полипептида који се називају тубулин алфа и бета. Они су полимеризовани тако да формирају микротубуле, које се састоје од тринаест протофиламената распоређених паралелно у облику шупље цеви.
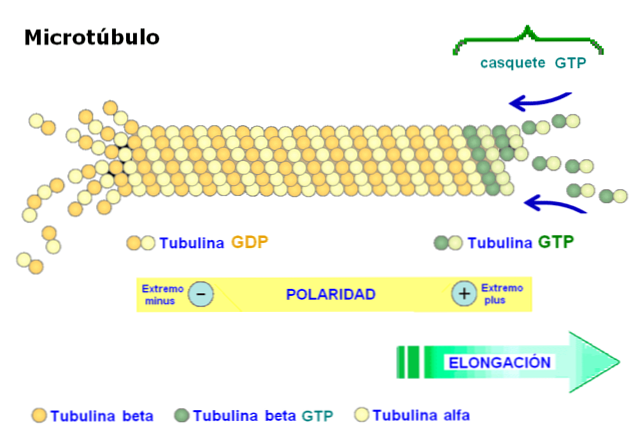
Једна од најважнијих карактеристика микротубула је поларитет структуре. Другим речима, два краја микротубула нису исти: један крај назива се брзо растући крај или "више", а други крај је споро растући или "мањи"..
Поларитет је важан, јер одређује смер кретања дуж микротубула. Тубулински димер је способан за полимеризацију и деполаризацију у циклусима брзог састављања. Овај феномен се јавља иу актин филаментима.
Постоји трећи тип подјединице: гама тубулин. Ово није део микротубула и налази се у центросомима; међутим, она учествује у нуклеацији и формирању микротубула.
Тубулин алфа и бета
Алфа и бета подјединице су снажно повезане да би формирале комплексни хетеродимер. Заправо, интеракција комплекса је толико интензивна да се не дисоцира под нормалним условима.
Ови протеини су формирани од 550 аминокиселина, углавном киселина. Иако су алфа и бета тубулини веома слични, они су кодирани различитим генима.
У тубулина алфа се могу наћи аминокиселински остаци са ацетилном групом, који дају различите особине у ћелијским флагелама.
Свака подјединица тубулина је повезана са два молекула: у тубулину алфа ГТП се неповратно везује и не долази до хидролизе једињења, док се друго место везивања тубулина бета реверзибилно веже за ГТП и хидролизује.
Хидролиза ГТП-а резултира феноменом званом "динамичка нестабилност", где микротубуле пролазе кроз циклусе раста и распада, у зависности од брзине зависности од тубулина и брзине хидролизе ГТП-а..
Овај феномен претвара се у високу стопу флуктуације микротубула, при чему је полуживот структуре само неколико минута.
Функције
Цитоскелетон
Алфа и бета подјединице полимеризују тубулину да би изазвале микротубуле, које су део цитоскелета.
Поред микротубула, цитоскелет се састоји од два додатна структурна елемента: микрофиламенти актина од око 7 нм и средњих филамената од 10 до 15 нм у пречнику..
Цитоскелет је оквир ћелије, даје му подршку и одржава ћелијски облик. Међутим, мембрана и субцелуларни одељци нису статични и стално се крећу да би могли да спроведу феномен ендоцитозе, фагоцитозе и секреције материјала.
Структура цитоскелета дозвољава ћелији да се прилагоди да испуни све наведене функције.
То је идеалан медиј за ћелијске органеле, плазма мембрану и друге ћелијске компоненте за обављање њихових уобичајених функција, поред учешћа у ћелијској подели..
Они такође доприносе појавама ћелијских покрета, као што су локомоција амоеба, и у специјализованим структурама за премјештање као што су цилије и флагеле. Коначно, она је одговорна за кретање мишића.
Митосис
Захваљујући динамичкој нестабилности, микротубуле се могу потпуно реорганизовати током процеса дељења ћелија. Уређај за микротубуле у току сучеља је у стању да се растави и тубулинске подјединице су слободне.
Тубулин се може поново окупити и потакнути митотичко вретено које учествује у раздвајању хромозома.
Постоје одређени лекови, као што су колхицин, таксол и винбластин који прекидају процесе дељења ћелија. Делује директно на молекуле тубулина, утичући на скупљање и феномен дисоцијације микротубула.
Центросоме
У животињским ћелијама, микротубули се простиру до центросома, структуре близу језгра формираног паром центриола (сваки је оријентисан окомито) и окружен аморфном супстанцом, названом перицентриоларна матрица..
Центриоле су цилиндрична тијела формирана од девет триплета микротубула, у организацији сличној ћелијским цилијама и флагелама.
У процесу дељења ћелија, микротубуле се протежу од центросома, формирајући митотичко вретено, одговорно за правилну дистрибуцију хромозома новим ћелијама кћери..
Чини се да центриоли нису неопходни за састављање микротубула унутар ћелија, јер нису присутне у биљним ћелијама или у неким еукариотским ћелијама, као у овулама одређених глодара..
У перицентриоларној матрици долази до иницијације за скупљање микротубула, где се нуклеација одвија уз помоћ гама тубулина..
Еволуцијска перспектива
Три типа тубулина (алфа, бета и гама) кодирани су различитим генима и хомологни су гену који се налази у прокариотима који кодирају протеин од 40.000 далтона, назван ФтсЗ. Бактеријски протеин је функционално и структурно сличан тубулину.
Вероватно је да је протеин имао функцију предака у бактеријама и био је модификован током еволутивних процеса, закључујући у протеину са функцијама које он игра у еукариота..
Референце
- Цардинали, Д.П. (2007). Примењена неурознаност: њени темељи. Ед Панамерицана Медицал.
- Цоопер, Г.М. (2000). Ћелија: молекуларни приступ. 2нд едитион. Сандерленд (МА): Синауер Ассоциатес.
- Цуртис, Х., & Сцхнек, А. (2006). Инвитатион то Биологи. Ед Панамерицана Медицал.
- Фрикионе, Е., & Меза, И. (2017). Живе машине: Како се станице крећу?. Фонд за економску културу.
- Лодисх Х, Берк А, Зипурски СЛ, ет ал. (2000). Молецулар Целл Биологи. 4тх едитион. Нев Иорк: В. Х. Фрееман.


