Својства калцијум хидрида (ЦаХ2), реактивност и употреба
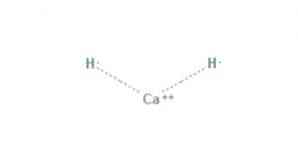
Тхе калцијум хидрид је хемијско једињење формуле ЦаХ2, што га чини земноалкалним хидридом. Ово хемијско једињење има две јонске везе између калцијума и два хидридна јона, као што је приказано на слици 1.
То је слани хидрид, што значи да је његова структура слична соли. Његова кристална структура је иста као и оловни хлорид (Цотунните минерал) као што је приказано на слици 2. \ т.

Сви алкални и земноалкални метали формирају хидридне соли. У хемији, хидрид је водонични анион, Х- или, још чешће, једињење у коме један или више водоничних центара имају нуклеофилне, редукционе или базичне особине.
У једињењима која се сматрају хидридима, атом водоника је везан за више електропозитивног елемента или групе.
Може се производити реаговањем калцијума и водоника на температури између 300 и 400 степени Целзијуса. Други начин за припрему калцијум хидрида је загревање калцијум хлорида заједно са водоником и металом натријума. Реакција се одвија на следећи начин:
ЦаЦл2 + Х2 + 2На → ЦаХ2 + 2НаЦл
У овој реакцији калциј (Ца) и водоник (Х) стварају молекул калцијум хидрида, док атоми натријума заједно са хлором стварају молекуле натријум хлорида (НаЦл)..
Калцијум хидрид се такође може произвести редуковањем калцијум оксида (ЦаО) са магнезијумом (Мг). Реакција се изводи у присуству водоника. Ова реакција такође производи магнезијум оксид (МгО). Испод је формула за ову хемијску реакцију:
ЦаО + Мг + Х2 → ЦаХ2 + МгО
Индек
- 1 Физичка и хемијска својства калцијум хидрида
- 2 Реактивност и опасности
- 3 Руковање и складиштење
- 4 Коришћење и апликације
- 4.1 Средство за сушење
- 4.2 Производња водоника
- 4.3 Редукционо средство
- 5 Недостатак у употреби калцијум хидрида
- 6 Референце
Физичке и хемијске особине калцијум хидрида
Калцијум хидрид је скуп кристала са белом орторомском структуром када је чист. Генерално, ретко је наћи у овом облику тако да обично има сивкасту нијансу. Недостаје му карактеристичан мирис. Његов изглед је приказан на слици 3 (Краљевско хемијско друштво, 2015).

Има молекулску тежину од 42,094 г / мол, има тачку топљења од 816 степени Целзијуса и густину од 1,70 г / мл. Ако се раствори у води, он реагује насилно производећи водоник. Такође реагује са алкохолом (Национални центар за биотехнолошке информације, С.Ф.).
Реактивност и опасности
Калцијум хидрид је стабилна хемикалија, иако је високо реактивна на воду или влагу. У контакту са водом ослобађа запаљиве гасове водоника који се спонтано могу запалити.
Сматра се експлозивним спојем. Када се загреје у реакцији са тетрахидрофураном, може изазвати експлозију. Када се помеша са хлоратом, хипохлоритом, броматом, калијум перхлоратом, постаје осетљив на топлоту, трење и постаје експлозив (Цалциум Хидриде 7789-78-8, 2016).
Када се сребрни флуорид здроби са калцијум-хидридом, маса постаје жарка. Снажно загревање хидрида са хлором, бромом или јодом доводи до усијања.
Смеше хидрида са различитим броматима, на пример барат бромат или хлорати, на пример баријум хлорат и перхлорати као што је калијум перхлорат, експлодирају након тритурације. ЦаХ2 реагује инцандесцентли са сребрним флуоридом ако је подвргнут трењу.
Ово једињење мора бити третирано у инертној атмосфери. Ако се њима не рукује на одговарајући начин, може представљати озбиљну пријетњу здрављу и сигурности особља лабораторија, спасилаца и руковалаца кемијским отпадом (УЦ центар за лабораторијску сигурност, 2013).
Изузетно опасан у случају додира са кожом или очима, јер је иритантан. Веома је опасно у случају додира са кожом јер може бити корозивно.
Опасан је иу случају гутања и удисања. Количина оштећења ткива зависи од дужине контакта. Контакт са очима може довести до оштећења рожњаче или слепила.
Контакт са кожом може изазвати упалу и пликове. Удисање прашине ће изазвати иритацију гастроинтестиналног или респираторног тракта, које карактерише спаљивање, кихање и кашљање.
Тешка прекомјерна изложеност може узроковати оштећење плућа, гушење, несвјестицу па чак и смрт. Упалу ока карактеришу црвенило, иритација и свраб. Упала коже карактеризира свраб, пилинг, црвенило или повремено стварање пликова.
Поновљено излагање очију ниском нивоу може изазвати иритацију очију. Поновљено излагање кожи може изазвати локално разарање коже или дерматитис.
Поновљено удисање прашине може изазвати различити степен иритације дишних путева или оштећења плућа. Поновљено или дуготрајно удисање прашине може узроковати хроничну иритацију дишних путева..
У случају контакта са очима, треба их одмах испрати са доста воде најмање 15 минута, повремено подижући горње и доње капке.
У случају контакта са кожом треба одмах испрати са доста воде најмање 15 минута док се уклања контаминирана одећа и обућа.
У случају гутања не треба изазивати повраћање. Требало би позвати центар за контролу отрова. Препоручује се да напустите изложбени простор и одмах се преселите на отворено.
У случају удисања, ако је дисање отежано, потребно је доставити кисик. Не би требало давати дисање од уста до уста ако је жртва прогутала или удахнула супстанцу.
Вештачко дисање треба изазвати помоћу џепне маске опремљене једносмерним вентилом или другим одговарајућим респираторним медицинским средством. У свим случајевима мора се одмах добити медицинска помоћ.
Руковање и складиштење
Једињење треба држати у сувом контејнеру даље од топлоте. Треба га држати даље од извора паљења. Не удисати прашину. У овај производ не треба додавати воду
У случају недовољне вентилације носити одговарајућу респираторну опрему као што је филтер маска. У случају излагања, треба потражити медицинску помоћ и показати етикету што је више могуће. Избегавајте контакт са кожом и очима.
Запаљиви материјали, генерално, треба да се чувају у одвојеном кабинету за безбедност или у остави. Чувајте посуду чврсто затворену.
Чувати на хладном и добро проветреном месту. Сва опрема која садржи материјал за избегавање електричних варница мора бити уземљена. Контејнер треба држати на сувом и на хладном месту.
То је незапаљив материјал. Међутим, ватрогасци морају да носе одговарајућу опрему док гасе пожар око овог хемијског једињења.
Никада није препоручљиво користити воду за гашење пожара око калцијум хидрида. Може се користити суви песак, као и једињења као што су натријум хлорид и натријум карбонат за ову сврху.
Да би се уклонио отпад калцијум хидрида, мора се разградити додавањем 25 мл метанола за сваки грам хидрида у атмосфери азота уз мешање.
Када је реакција завршена, исти волумен воде се додаје воденом једињењу калцијум-метоксида и испушта у одвод са пуно воде (Натионал Ресеарцх Цоунцил, 1995)..
Користи и апликације
Средство за сушење
Калијум хидрид је релативно благи десикант. Из тог разлога, употреба овог једињења као средства за сушење је сигурнија у поређењу са више реактивних агенаса, као што су натријум-калијум и легуре метала натријума. Реагује са водом на следећи начин:
ЦаХ2 + 2 Х20 → Ца (ОХ) 2 + 2 Х2
Продукти хидролизе ове реакције, водоник (гас) и Ца (ОХ) 2 (водена смеша), могу да се одвоје од хемијског растварача након процеса филтрације, дестилације или декантације..
Ово хемијско једињење је ефикасно средство за сушење за многе основне раствараче као што су амини и пиридин. Понекад се користи за претходно сушење растварача пре коришћења више реактивних десиканата.
Производња водоника
Током 1940-их, ово једињење је било доступно као извор водоника под трговачким називом "Хидролитх".
Дуго се користи као извор водоника. И даље се користи за производњу чистог водоника у лабораторијама за разне експерименте, напредне горивне ћелије и апликације батерија (Америцан Елементс, С.Ф.).
Ово једињење је деценијама широко коришћено као безбедно и погодно средство за надувавање балона.
Исто тако, он се редовно користи у лабораторијама за производњу малих количина високо чистог водоника за експерименте. Садржај влаге у дизел гориву се израчунава помоћу водоника развијеног након третмана са ЦаХ2.
Редуцирање агента
Када се загрева између 600 и 1000 степени Целзијуса, цирконијум оксид, ниобијум, уранијум, хром, титанијум, ванадијум и тантал могу се редуковати да би се припремио прах ових метала, тако да се калцијум хидрид може користити у металургији. прашине.
Следећа реакција илуструје начин на који калцијум хидрид делује као редукциони агенс:
ТиО + 2ЦаХ2 → ЦаО + Х2 + Ти
Недостатак у употреби калцијум хидрида
Ово хемијско једињење је често пожељан избор као средство за сушење; Међутим, има и неке недостатке:
-Поступак сушења овог једињења је спор, пошто није растворљив у било ком растварачу са којим не реагује насилно.
-Ово прашкасто једињење је некомпатибилно са многим растварачима. Ваша реакција са хлоровим угљеницима може чак изазвати експлозије.
-Не може се користити за отапала која садрже кисик, јер не могу елиминирати отопљени кисик.
-Разликовање калцијум-хидрида и калцијум-хидроксида је веома тешко због сличног изгледа.
Референце
- Америцан Елементс. (С.Ф.). калцијум хидрид. Добављено из америцанелементс.цом: америцанелементс.цом.
- Калцијум хидрид 7789-78-8. (2016). Добављено из цхемицалбоок.цом: цхемицалбоок.цом.
- калцијум хидрид. (с.ф.). Преузето из хемије ученик: цхемистрилеарнер.цом.
- Лист са подацима о безбедности материјала Калцијум хидрид МСДС. (2005, 10. октобар). Добављено из сциенцелаб.цом: сциенцелаб.цом.
- Национални центар за биотехнолошке информације. (С.Ф.). ПубЦхем Цомпоунд Датабасе; ЦИД = 105052. Преузето са пубцхем.нцби.нлм.них.гов: пубцхем.нцби.нлм.них.гов.
- национални истраживачки савет. (1995). Разборите праксе у лабораторији: руковање и одлагање хемикалија. Васхинтон: НатионалАцадеми Пресс.
- Краљевско хемијско друштво. (2015). калцијум хидрид ИД 94784. Добављено из цхемспидер.цом: цхемспидер.цом.
- УЦ центар за лабораторијску сигурност. (2013, 18. јануар). стандардни оперативни поступак калцијум хидрид. Добављено из цхеменгр.уцсб.еду: цхеменгр.уцсб.еду.


