Структура, својства, употреба и ризик етана
Тхе етхане је једноставан угљоводоник формуле Ц2Х6 са природом гаса без боје и мириса који има веома драгоцену и разнолику употребу у синтези етилена. Поред тога, то је један од земаљских гасова који је такође откривен у другим планетама и телима звезда око Сунчевог система. Открио га је научник Мајкл Фарадеј 1834. године.
Међу великим бројем органских једињења насталих угљениковим и водониковим атомима (познатим као угљоводоници), налазе се и они који су у гасовитом стању на температурама и притисцима из околине, који се користе у многим индустријама..
Они обично долазе из гасне смеше која се назива "природни гас", производа високе вредности за човечанство, и метана, метана, етана, пропана и бутана, између осталих; класификовано према количини угљеникових атома у свом ланцу.
Индек
- 1 Хемијска структура
- 1.1 Синтеза етана
- 2 Својства
- 2.1 Растворљивост етана
- 2.2 Кристализација етана
- 2.3 Сагоревање етана
- 2.4 Етан у атмосфери и небеским тијелима
- 3 Усес
- 3.1 Производња етилена
- 3.2 Обука основних хемикалија
- 3.3 Расхладно средство
- 4 Ризици етана
- 5 Референце
Хемијска структура
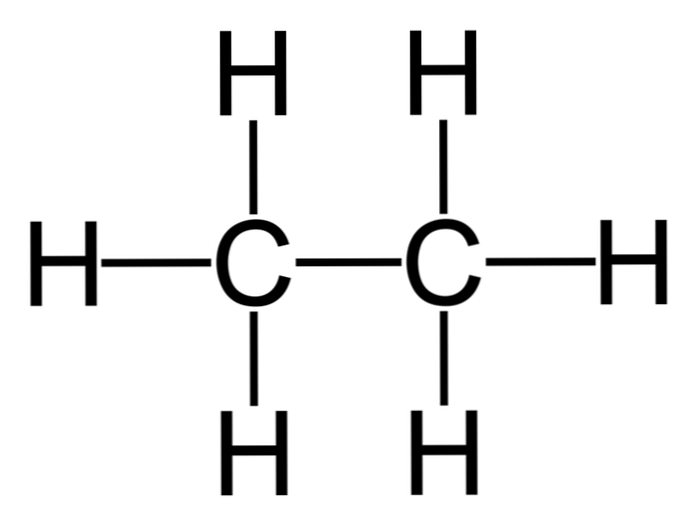
Етан је молекул са формулом Ц2Х6, обично се посматра као спој две метил групе (-ЦХ)3) да се формира угљоводоник једноставне везе угљеник-угљеник. То је уједно и најједноставније органско једињење након метана.
Х3Ц-ЦХ3
Атоми угљеника у овом молекулу поседују сп хибридизацију3, тако да молекуларне везе представљају слободну ротацију.
Такође, постоји и унутрашњи феномен етана, који се заснива на ротацији молекуларне структуре исте и минималне енергије потребне да се произведе ротација везе од 360 степени, коју су научници назвали "етан баријера"..
Из тог разлога, етан се може појавити у различитим конфигурацијама у складу са његовом ротацијом, иако његова стабилнија конформација постоји тамо где су водици супротни један другом (као што је приказано на слици).

Синтеза етана
Етан се може лако синтетисати из електролизе Колбе, органске реакције у којој се одвијају два корака: електрокемијска декарбоксилација (уклањање карбоксилне групе и ослобађање угљен диоксида) две карбоксилне киселине, и комбинација производа међупроизводи да се формира ковалентна веза.
Слично томе, електролиза сирћетне киселине доводи до формирања етана и угљен-диоксида, а ова реакција се користи за синтезу првог.
Оксидација анхидрида сирћетне киселине дејством пероксида, концепт сличан оном Колбеове електролизе, такође доводи до формирања етана.
На исти начин, може се ефикасно одвојити од природног гаса и метана процесом укапљивања, користећи криогене системе за хватање овог гаса и одвајање од смеша са другим гасовима..
Процес турбо експанзије је пожељан за ову улогу: мјешавина гаса се пропушта кроз турбину, стварајући њено ширење, све док њена температура не падне испод -100ºЦ.
Већ у овом тренутку, компоненте смеше се могу разликовати, тако да ће течни етан бити одвојен од гасовитог метана и других врста укључених у дестилацију..
Пропертиес
Етан се јавља у природи као гас без мириса и безбојан при стандардним притисцима и температурама (1 атм и 25 ° Ц). Има тачку кључања од -88,5 ºЦ и тачку топљења -182,8 ºЦ. Осим тога, не утиче на изложеност јаким киселинама или базама.
Растворљивост етанола
Молекули етана су симетричне конфигурације и имају слабе силе привлачности које их држе заједно, називају се силе дисперзије.
Када се етан покушава растопити у води, силе привлачења формиране између гаса и течности су веома слабе, тако да је врло тешко придружити се етану са молекулима воде..
Из тог разлога, растворљивост етана је значајно ниска, повећавајући се незнатно када притисак у систему расте.
Кристализација етана
Етан се може очврснути, што доводи до формирања нестабилних кристала етана са кубичном кристалном структуром.
Са падом температуре изнад -183,2 ° Ц, ова структура постаје моноклинична, повећавајући стабилност њеног молекула.
Изгарање етана
Овај угљоводоник, иако се не користи широко као гориво, може се користити у процесима сагоревања да би се произвео угљен диоксид, вода и топлота, што је представљено на следећи начин:
2Ц2Х6 + 7О2 → 4ЦО2 + 6Х2О + 3120 кЈ
Постоји и могућност сагоревања овог молекула без вишка кисеоника, који је познат као "непотпуно сагоревање", а који резултира у формирању аморфног угљеника и угљен моноксида у нежељеној реакцији, у зависности од количине примењеног кисеоника. :
2Ц2Х6 + 3О2 → 4Ц + 6Х2О + Хеат
2Ц2Х6 + 4О2 → 2Ц + 2ЦО + 6Х2О + Хеат
2Ц2Х6 + 5О2 → 4ЦО + 6Х2О + Хеат
У овој области, сагоревање се одвија кроз низ реакција слободних радикала, које су нумерисане у стотинама различитих реакција. На пример, једињења као што су формалдехид, ацеталдехид, метан, метанол и етанол могу да се формирају у непотпуним реакцијама сагоревања..
Ово ће зависити од услова под којима се реакција одвија и укључених реакција слободних радикала. Етилен може да се формира и на високим температурама (600-900 ºЦ), што је производ који је индустрија веома пожељна.
Етан у атмосфери и небеским телима
Етан је присутан у атмосфери планете Земље у траговима, а сумња се да је човек успео да удвостручи ову концентрацију од када је почео да се бави индустријским активностима..
Научници сматрају да је садашње присуство етана у атмосфери због сагоријевања фосилних горива, иако је глобална емисија етана смањена за скоро половину од побољшања технологије производње гаса из шкриљаца ( извор природног гаса).
Ова врста се природно производи и дејством сунчевих зрака на атмосферски метан, који рекомбинује и формира молекул етана..
Етан постоји у течном стању на површини Титана, једног од Сатурнових месеца. То се јавља у већој количини у ријеци Вид Флумина, која тече више од 400 километара према једном од својих мора. Такође је доказано да је ово једињење на кометама и на површини Плутона.
Усес
Производња етилена
Употреба етана заснива се углавном на производњи етилена, најраширенијег органског производа у светској производњи, кроз процес познат као парни крекинг..
Овај процес се састоји у пропуштању хране етана разблажене са паром у пећ, загревајући је брзо без кисеоника.
Реакција се одвија на екстремно високој температури (између 850 и 900 ºЦ), али вријеме задржавања (вријеме проведено у етану у пећи) мора бити кратко за реакцију. При вишим температурама настаје више етилена.
Обука основних хемикалија
Етан је такође проучаван као главна компонента у формирању основних хемикалија. Оксидативно хлорисање је један од процеса за добијање винил хлорида (компонента ПВЦ-а), који замењује јефтиније и компликованије \ т.
Цоолант
Коначно, етан се користи као расхладно средство у заједничким криогеним системима, такође показује способност да замрзне мале узорке у лабораторији за анализу.
То је веома добра замена за воду, која траје дуже да хлади деликатне узорке, а такође може да генерише стварање штетних ледених кристала.
Етхане рискс
-Етан има способност да се запали, посебно када се веже са ваздухом. У процентима од 3,0 до 12,5% запремине етана у ваздуху, може настати експлозивна смеша.
-Може да ограничи кисеоник у ваздуху у коме се налази, и због тога представља фактор ризика гушења за људе и животиње који су присутни и изложени.
-Етан у замрзнутој течној форми може озбиљно опећи кожу ако дође у директан контакт са њом, а такође делује као криогени медиј за било који предмет који додирује, замрзавајући га за неколико тренутака..
-Паре течног етана су теже од ваздуха и концентрисане су на земљи, што може представљати ризик од паљења које може изазвати реакцију сагоревања ланца.
-Уношење етана може изазвати мучнину, повраћање и унутрашње крварење. Удисање, поред гушења, изазива главобоље, збуњеност и промене расположења. Смрт због срчаног застоја је могућа при високим излагањима.
-Представља стакленички плин који, заједно са метаном и угљичним диоксидом, доприноси глобалном загријавању и климатским промјенама узрокованим људским загађењем. Срећом, он је мање обилан и издржљив од метана и апсорбује мање зрачења од овога.
Референце
- Британница, Е. (с.ф.). Етхане. Преузето са британница.цом
- Нес, Г. В. (с.ф.). Једнокристалне структуре и дистрибуција електронске густине етана, етилена и ацетилена. Рецоверед фром руг.нл
- Ситес, Г. (с.ф.). Етхане: Извори и судопери. Преузето са ситес.гоогле.цом
- СофтСцхоолс. (с.ф.). Етхане Формула. Рецоверед фром софтсцхоолс.цом
- Википедиа. (с.ф.). Етхане. Преузето са ен.википедиа.орг


