Својства натријум-дикромата, производња, опасности и употреба
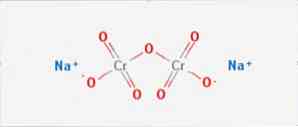
Тхе натријум дикромат је неорганско једињење формуле На2Цр207. Он је један од многих хексавалентних хромних једињења (Цр ВИ). Његова структура је илустрована на слици 1, мада се обично рукује сољу у њеном дихидратном облику чија би формула била На2Цр2О7 · Х2О.
Има две јонске везе између молекула натријума и негативно набијених кисеоника. Хромова руда се екстрахује из натријум-дикромата. Годишње се производе милиони килограма натријум-дикромата.
Кина је највећи произвођач натријум-дикромата, међутим, кинеске хемијске фабрике имају релативно ниску производњу, мање од 50.000 тона годишње, у поређењу са казахстанским погоном који производи више од 100.000 тона годишње.
Постројења у Русији, Сједињеним Државама и Уједињеном Краљевству имају међупроизвод између 50.000 и 100.000 тона годишње (Когел, 2006).
У погледу реактивности и изгледа, натријум дикромат има особине сличне калијум дикромату, међутим, натријумова со је растворнија у води и има тежину која је мања од калијумове соли..
Натријум дихромат производи токсичне паре хрома када се загрева. То је јако средство за оксидацију и јако корозивно.
Ово једињење се може наћи у изворима питке воде контаминираним различитим индустријским процесима као што су технике галванизације или галванизације, штављење коже и производња текстила.
Индек
- 1 Физичка и хемијска својства
- 2 Методе производње
- 3 Реактивност и опасности
- 4 Коришћење и апликације
- 5 Биоцхемистри
- 6 Референце
Физичке и хемијске особине
Натријум дикромат се састоји од кристала са црвенкасто наранџастом моноклинском структуром у облику безводног и без мириса. Његова молекулска маса је 261,97 г / мол у анхидрованом облику и 298,00 г / мол у дихидратној форми.
Има тачку топљења од 356,7 степени Целзијуса, тачку кључања од 400 степени Целзијуса у којој се распада. Има густину од 2.52 г / мл.

Слика 2 приказује изглед натријум-дикромата. Његова растворљивост у води је 187 г на 100 грама на 25 степени Целзијуса, а његова растворљивост у етанолу је 513,2 грама по литру на 19,4 степена Целзијуса (Национални центар за биотехнолошке информације, с.ф.).
Сматра се стабилним спојем ако се складишти у препорученим условима и није запаљив. Пошто је то јако оксидационо средство, корозивно је, ау раствору је киселина која има способност да смањи пХ на 4 у раствору од 1% в / в..
Методе производње
Натријум-хромат се може конвертовати у дикромат помоћу непрекидног процеса који третира сумпорном киселином, угљен-диоксидом или комбинацијом ова два.
Испаравање течности натријум-дикромата доводи до таложења натријум-сулфата и / или натријум-бикарбоната, и ова једињења се уклањају пре коначне кристализације натријум-дикромата..
Натријум-дихромат се може обавити у три корака:
- Алкално печење оксидационих услова хромита
- Леацхинг. Екстракција растворне материје из смеше дејством течног растварача
- Конверзија натријум монохромата у натријум дикромату помоћу киселине.
Анхидровани натријум дикромат може се припремити топљењем дихидрата натријум дихидрата, растворима растворних водоник дикромата изнад 86 степени Ц, или сушењем раствора натријум дикромата у спреј сушачима.
Отопине натријум-дикромата на 69 и 70% в / в користе се као погодан и економичан начин слања количина, избегавајући потребу за ручним руковањем или растварањем кристала.
Реактивност и опасности
То је јако средство за оксидацију. Некомпатибилно са јаким киселинама. Контакт са запаљивим материјалима може изазвати пожар. Токсичне паре хромовог оксида могу се формирати у присуству топлоте или ватре.
Позната смеша хромне киселине дикромата и сумпорне киселине са органским остацима доводи до јаке егзотермне реакције. Ова смеша у комбинацији са остацима ацетона такође доводи до насилне реакције.
Комбинација дикромата и сумпорне киселине са алкохолима, етанолом и 2-пропанолом доводи до јаке егзотермне реакције. Због појаве многих инцидената који укључују мешање дикромат-сумпорне киселине са органским материјалима који се могу оксидовати, вероватно је најбоље избећи такве интеракције.
Комбинација дикромата са хидразином је експлозивна, може се очекивати да је реакција дикромата снажна са аминима уопште. Додавање дехидриране дихроматне соли у анхидрид ацетатне киселине доводи до коначно експлозивне егзотермне реакције.
Бор, силициј и дикромати формирају пиротехничке смеше. Мешавина сирћетне киселине, 2-метил-2-пентенала и дикромата доводи до необуздане реакције (Цхемицал Датасхеет Содиум Дицхромате., 2016).
Удисање прашине или магле изазива иритацију респираторних органа која понекад подсећа на астму. Може доћи до перфорације септума. Сматра се отровом.
Гутање узрокује повраћање, дијареју и, веома неуобичајено, компликације желуца и бубрега. Контакт са очима или кожом изазива локалну иритацију. Поновљено излагање кожи узрокује дерматитис.
Натријум дикромат је канцероген код људи. Постоје докази да хексавалентни хромни спојеви или Цр (ВИ) могу изазвати рак плућа код људи. Показано је да натријум дикромат изазива рак плућа код животиња.
Иако натријум дикромат није идентификован као тератогено једињење или репродуктивни ризик, познато је да су хексавалентни хромни спојеви или Цр (ВИ) тератогени и изазивају репродуктивна оштећења као што су смањење плодности и ометање менструалног циклуса..
Натријум-дикромат може проузроковати оштећење јетре и бубрега, тако да се њиме мора управљати са највећом пажњом (Департмент оф Хеалтх, Нев Јерсеи, 2009).
У случају гутања, жртва треба да пије воду или млеко; никада не изазивати повраћање. У случају додира са кожом или очима, третирати их као опекотине од киселине; Исперите очи водом најмање 15 минута.
Спољашње лезије се могу утрљати са 2% раствором натријум тиосулфата. У свим случајевима треба консултовати лекара.
Користи и апликације
Поред његовог значаја у производњи других хромних хемикалија, натријум дикромат такође има многе директне употребе као састојак у производњи:
- Метална завршна обрада: помаже у отпорности на корозију и чисти металне површине, а погодује и пријањању боје.
- Органски производи: користе се као оксидациони агенси у производњи производа као што су витамин К и восак.
- Пигменти: користе се у производњи неорганских хроматских пигмената, где се производе различите боје стабилне на светло. Неке врсте хромата се такође користе као инхибитори корозије у доњим слојевима и прајмерима.
- Керамика: користи се за припрему обојених стакала и керамичких глазура.
- Текстил: користи се као средство за чишћење киселих боја ради побољшања његових својстава брзог бојења.
- Производња хром сулфата.
(Натријум дикромат, Грађевни блок за практично све остале спојеве хрома., 2010-2012)
Натријум дихидрат Дихидрат, његова употреба је идеална у различитим условима, укључујући примену на високим температурама, као што су керамичке глазуре и обојено стакло..
Хромни оксид, који је тврђи од других оксида метала, као што је титан или гвожђе, идеалан је за окружења у којима су услови температуре и процеса агресивни.
Ова супстанца се углавном користи за производњу других хромових једињења, али се такође користи у бентонитним муљевима који се користе у производњи уља, у конзервансима дрва, у производњи органских хемикалија и као инхибитор корозије..
Када се помеша са алуминијумом и калијум-дикроматом, користећи алумино-термички процес, хромни оксид производи метални хром високе чистоће. Ово је витални састојак у производњи суперзлитина високих перформанси који се користе у ваздухопловној индустрији.
У органској синтези, натријум-дихромат се користи као оксидациони агенс у реакцијама редукционих оксида у присуству сумпорне киселине.
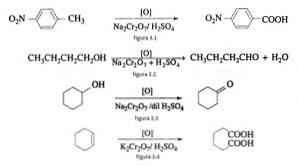
На пример, оксидација п-нитротолуена да би се формирала п-нитробензоева киселина, у оксидацији н-бутанола да би се формирао н-буталдехид, у формирању циклохексанона из циклохексанола и формирање адипинске киселине као што је приказано на сликама 3.1 , 3.2, 3.3 и 3.4 (ВК Ахлувалиа, 2004).
Биоцхемистри
Интратрахеална инстилација натријум-дикромата (ЦрВИ) и хром-ацетат-хидроксида (ЦрИИИ) код мужјака пацова довела је до повећања концентрације хрома у пуној крви, плазми и урину до 72 сата након излагања; Максималне концентрације су постигнуте 6 сати након излагања.
Однос концентрација хрома у плазми и концентрације хрома у плазми био је значајно различит за третмане Цр (ВИ) и Цр (ИИИ). Стога, за процену изложености хромом треба користити анализе хрома у крви и хрома у плазми.
Хром је такође детектован у периферним лимфоцитима. Цр (ВИ), али не и Цр (ИИИ) акумулира се значајно у лимфоцитима након третмана. Ове ћелије имају потенцијал да се користе као биомаркери у процени изложености хромовим једињењима (Хоотх, 2008).
Референце
- Цхемицал Датасхеет Содиум Дицхромате. (2016). Преузето из хемијске хемије: цамеоцхемицалс.ноаа.
- Хоотх, М.Ј. (2008). Технички извештај о студијама токсикологије и карциногенезе натријум-дихромата дихидрираних. Национални институт за здравље САД.
- Когел, Ј.Е. (2006). Индустријски минерали и стијене: сировине, тржишта и користи седмо издање. литтлетон цолорадо: друштво за рударство, металургију и истраживање инц.
- Национални центар за биотехнолошке информације. (с.ф.). ПубЦхем Цомпоунд Датабасе; ЦИД = 25408. Преузето са пубцхем.цом: пубцхем.нцби.нлм.них.гов.
- Нев Јерсеи Департмент оф Хеалтх. (2009, новембар). хазартдозна супстанца. Добављено из њ.гов: њ.гов.
- Натријум дикромат. Градитељски блок за све остале спојеве хрома. (2010-2012). Преузето са елементис цхромиум: елементисцхромиум.цом
- К. Ахлувалиа, Р. А. (2004). Свеобухватна практична органска хемија: препарати и квантитативне анализе. Делхи: Универзитетска штампа (Индија).


