Карактеристичне особине материје (физичка и хемијска)
Тхе карактеристична својства материје оне су хемијске или физичке особине које могу помоћи у идентификацији или разликовању једне супстанце од друге. Физичка својства су карактеристике супстанце која се посматра са чулима. Хемијска својства су карактеристике које описују како се супстанца мења из једне супстанце у другу током хемијске реакције.
Неке физичке особине супстанце су густина, растворљивост, тачка топљења, боја и маса. Хемијска својства материјала укључују запаљивост, реактивност са киселинама и корозију. Неки примери како својства материје могу помоћи у идентификацији елемента је да се упореде густине различитих елемената.
Елемент као што је злато има густину од 19,3 грама по кубном центиметру док је густина сумпора 1,96 грама по кубном центиметру. Слично томе, тачке топљења супстанци као што су вода и изопропил алкохол су различите.
Физичке особине материје
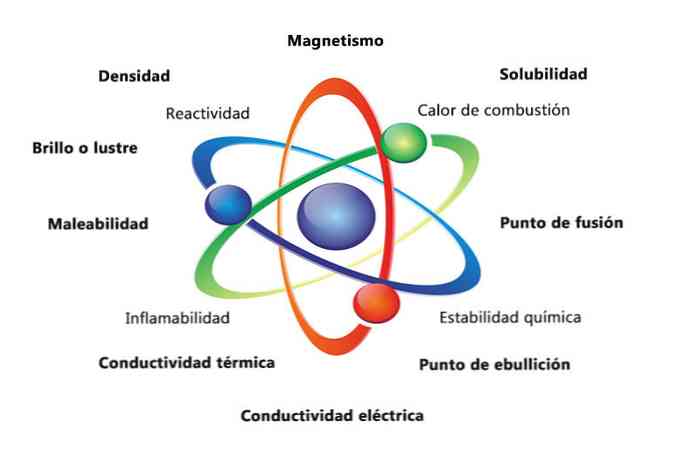
Физичка својства материје су својства која се могу мјерити или проматрати без промјене кемијске природе твари. Неки примери физичких својстава су:
- Густина: количина материје која има објекат, израчунава се дељењем масе по запремини.
- Магнетизам: сила привлачења између магнета и магнетног објекта.
- Растворљивост: мјера колико се твар може отопити у другој супстанци.
- Тачка топљења: температура на којој се супстанца мења од чврсте до течне.
- Тачка кључања: температура на којој се супстанца мења из течности у гас.
- Електрична проводљивост: је мјера колико се струје крећу кроз твар.
- Топлотна проводљивост: брзина којом супстанца преноси топлоту.
- Способност: је способност супстанце да се ваља или меље на различите начине.
- Сјај или сјај: колико лако објекат рефлектује светлост.
Хемијска својства материје
Хемијска својства описују способност супстанце да се трансформише у нову супстанцу са различитим својствима. Испод је неколико примера хемијских својстава:
- Топлина сагоревања: је енергија која се ослобађа када се једињење потпуно сагори са кисеоником.
- Хемијска стабилност: односи се на то да ли ће једињење реаговати са водом или ваздухом (хемијски стабилне супстанце неће реаговати).
- Запаљивост: способност једињења да изгори када је изложен пламену.
- Реактивност: способност интеракције са другом супстанцом и формирањем једне или више нових супстанци.
Физичка стања материје
Материја је све што заузима простор, који има масу и која се може опажати нашим чулима. Материја се може класификовати према свом физичком стању: чврстом, течном и гасовитом.
1- Чврсте материје и њихове карактеристичне особине
Све чврсте материје имају масу, заузимају простор, имају дефинисан волумен и облик, не проклизавају кроз простор и не могу се компримирати или имати крути облик. Као пример имамо: дрво, књиге, спужве, метал, камење, итд..
Код чврстих материја, мале честице материје су веома близу и додирују се. Честице су толико близу да не могу много да се померају, постоји веома мало простора између њих.
2 - Течности и њихове карактеристичне особине
Све течности имају масу, заузимају простор, имају дефинисани волумен, али не и дефинисан облик (пошто се прилагођавају контејнеру тамо где се налазе), могу да се компримују у веома малом степену и могу да клизе кроз простор. Као пример имамо: воду, керозин, уље, итд..
У течностима, мале честице материје су мало даље једна од друге, има више простора између њих (у односу на чврсте материје) и не додирују се. Због тога се честице могу кретати између простора, гурати и сударити се са другим честицама, стално мијењајући смјер.
3- Гасови и њихова карактеристична својства
Сви гасови имају масу, заузимају простор, немају дефинисани волумен или облик, могу се у великој мери сабити и могу дифундовати у свемир. Као пример имамо: водоник, кисеоник, азот, угљен диоксид, пару, итд..
У гасовима, мале честице материје су много удаљеније, између њих је много више простора (у односу на течности) и не додирују се. Честице имају максималну слободу кретања тако да гурају и сударају се са другим честицама које стално мењају правац.
Промене стања материје
Материја се може претворити из чврстог стања у текуће стање и обратно, и из текућег стања у гасовито стање и обрнуто. Ова конверзија узима назив промене стања материје и дешава се променом температуре:
Фусион
Промена стања материјала од чврсте до течне помоћу повећања температуре. Када се загреје чврста супстанца, топлота узрокује да честице вибрирају снажније.
Када достигну тачку топљења, чврсте честице имају довољну кинетичку енергију да превладају енергетске силе привлачења које их држе у фиксним положајима, и оне се разбијају да би формирале мале групе течних честица..
Врелиште или испаравање
Променом стања течне материје у гасовито повећањем температуре. Када се течна супстанца загреје, топлота чини честице још бржим.
Када достигну тачку кључања, течне честице имају довољну кинетичку енергију да превладају силе привлачења које их држе у фиксним положајима и раздвајају у појединачне гасне честице..
Замрзавање или скрућивање
Промена стања течне материје на чврсту помоћу пада температуре. Када се течна материја охлади, њене честице губе велику кинетичку енергију. Када достигну тачку смрзавања, честице престају да се крећу и вибрирају у фиксној позицији и постају чврсте честице.
Укапљивање или кондензација
Промена стања гасне материје у течност смањењем температуре. Када се гасовита супстанца охлади, њене честице губе велику кинетичку енергију која узрокује њихово међусобно привлачење и постају течне честице.
Сублимација
Неки материјали се директно измјењују из чврстог стања у плиновито стање или обрнуто, без проласка кроз текуће стање. Када се те чврсте супстанце загреју, њихове честице се крећу тако брзо да раздвајају потпуно формирајући пару или гас, и обрнуто када се процес одвија од гасне до чврсте супстанце.
Референце
- Де Подеста, М. Разумевање својстава материје, 2. издање. Велика Британија: Таилор & Францис.
- Гоел А. Стања материје. Нев Делхи: Дисцовери Публисхинг Хоусе.
- Мооре Ј, Станитски Ц. Молекуларна наука, 5. издање. Стамфорд: Ценгаге Леарнинг.
- Рамакрисхна А. Природа материје, 1. издање. Нев Делхи: Гоиал Бротхерс Пракасхан.
- Регер Д, Гооде С, Балл Д. Хемија. Принципи и пракса, 3. издање. Канада: Броокс / Цоле, Ценгаге Леарнинг.
- Схапере Д. Маттер (физика). Преузето са: аццесссциенце.цом.
- Сингх Л, Каур М. Материја у нашој околини. Индиа: С. Цханд Сцхоол.


